Фізичні та хімічні властивості основ
Про матеріал
Презентація на тему: Фізичні та хімічні властивості основ. Зроблена як додатковий матеріал на урок. Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку



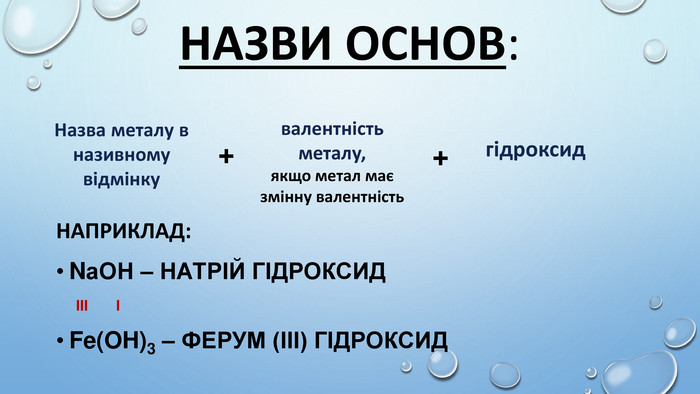
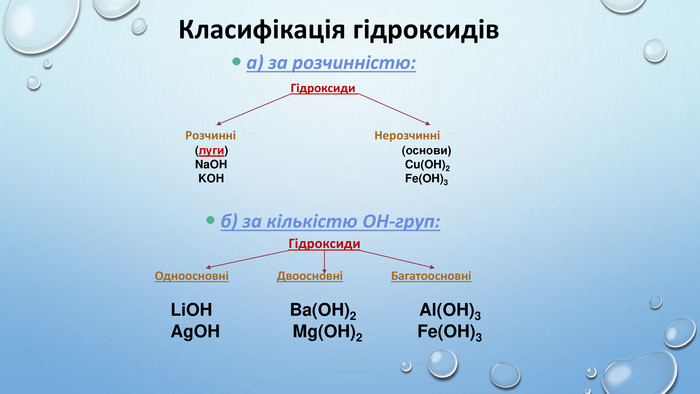





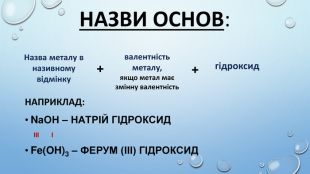
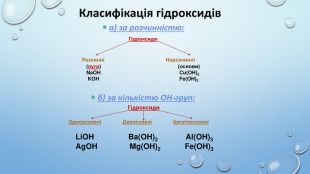
![Ca(OH)2 – відомий під назвою «гашене вапно», широко використовують у будівництві. Суміш гашеного вапна з піском і водою називають вапняним розчином і використовують для скріплення цегли під час мурування цегляних стін, а також як штукатурка. Вапняний розчин твердне спочатку внаслідок випаровування води, а потім – внаслідок вбирання гашеним вапном з повітря вуглекислого газу й утворення кальцій карбонату. Ca(OH)2 використовують для добування хлорного вапна [Са(ОН)2 + Сl2 → Ca. OCl2 + H2 O]. Як «вапняну воду» застосовують для білення, у медицині проти опіків або як протиотруту при отруєннях сульфатною чи оксалатною кислотами. Ba(OH)2 – насичений водний розчин відомий як «баритова вода», є важливим лабораторним реактивом для виявлення СО2, йонів SO42– та СO32– та відносно дешевою розчинною основою. Ca(OH)2 – відомий під назвою «гашене вапно», широко використовують у будівництві. Суміш гашеного вапна з піском і водою називають вапняним розчином і використовують для скріплення цегли під час мурування цегляних стін, а також як штукатурка. Вапняний розчин твердне спочатку внаслідок випаровування води, а потім – внаслідок вбирання гашеним вапном з повітря вуглекислого газу й утворення кальцій карбонату. Ca(OH)2 використовують для добування хлорного вапна [Са(ОН)2 + Сl2 → Ca. OCl2 + H2 O]. Як «вапняну воду» застосовують для білення, у медицині проти опіків або як протиотруту при отруєннях сульфатною чи оксалатною кислотами. Ba(OH)2 – насичений водний розчин відомий як «баритова вода», є важливим лабораторним реактивом для виявлення СО2, йонів SO42– та СO32– та відносно дешевою розчинною основою.](/uploads/files/417980/177126/189873_images/10.jpg)