Характеристика хімічних елементів
Закріпити знання учнів про будову атома; формувати вміння й навички характеризувати елементи за положенням у періодичній системі й будову атома. Закріпити навички написання електронних схем. Розвивати в учнів почуття взаємодопомоги, взаєморозуміння, вміння працювати в колективі.
урок хімії ( 8 клас )
Тема: Характеристика хімічних елементів за положенням у періодичній системі хімічних елементів і будовою атома
Мета: закріпити знання учнів про будову атома; формувати вміння й навички характеризувати елементи за положенням у періодичній системі й будову атома. Закріпити навички написання електронних схем. Розвивати в учнів почуття взаємодопомоги, взаєморозуміння, вміння працювати в колективі.
Тип уроку: засвоєння вмінь і навичок
Форми роботи: фронтальна робота, індивідуальна робота, тренувальні вправи.
Обладнання: періодична система хімічних елементів, план характеристики хімічних елементів, роздаткові картки, кольорові папірці , кубики з написами хімічних елементів.
Структура уроку з хронометражем:
1. Організаційний момент – 1 хв.
2. Актуалізація опорних знань – 7 хв.
3. Мотивація навчальної та пізнавальної діяльності – 3 хв.
4. Вивчення нового матеріалу – 23 хв.
5. Фізкультхвилинка – 2 хв.
6. Закріплення матеріалу – 8 хв.
7.Домашнє завдання – 1 хв.
Хід уроку
I. Організаційний момент
Нумо, діти, підніміться
Всі приємно посміхніться.
Продзвенів уже дзвінок,
Починаємо урок.
II. Актуалізація опорних знань
- 2 учня працюють з роздатковими картками
(заповнення таблиці за темою «Будова атома» )
|
назва елемента |
хіміч. символ |
поряд. номер |
заряд ядра |
p+ |
n0 |
e- |
|
нітроген |
|
|
|
|
|
|
|
кальцій |
|
|
|
|
|
|
|
ферум |
|
|
|
|
|
|
|
силіцій |
|
|
|
|
|
|
|
калій |
|
|
|
|
|
|
- 2 учня працюють біля дошки:
електронна формула Ba Ne
+18 Ar поряд. номер
+30 Zn протони
електрони
нейтрони
- Весь клас працює з роздатковими картками
(вставити пропущені слова в речення)
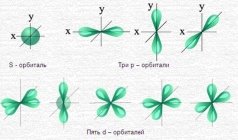
- Існують такі види орбіталей………………(s, p, d, f)
- На s – орбіталі максимум розміщується 2 електрони, а на p – орбіталі – 6 електронів.
- На заряд ядра атома і кількість електронів вказує …………. поряд. номер
- Кількість енергетичних рівнів (оболонок) визначається за номером періоду
- Кількість електронів на зовнішньому рівні визначається за …….номером групи
 Перевірка завдань на дошці та взаємоперевірка робіт з роздатковими картками.
Перевірка завдань на дошці та взаємоперевірка робіт з роздатковими картками.
III. Мотивація навчальної та пізнавальної діяльності
Проблемне питання:
- Чи повна інформація про хімічні елементи міститься на дошці?
Щоб надати інформацію про елементи існує план характеристики елемента за положення у періодичній системі.
IV.Вивчення нового матеріалу
1. Знайомство з планом характеристики хімічного елемента
(робота з підручником )
 2. Характеристика хімічного елемента за планом (по ланцюжку).
2. Характеристика хімічного елемента за планом (по ланцюжку).
Хімічний елемент, що характеризується, визначається за допомогою кубика, на гранях якого написані елементи.
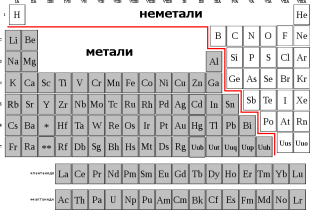
3. На дошці кольорові папірці, під якими записані символи хімічних елементів. Учні по стислому опису повинні назвати ці елементи
(по першим літерам кожного елементу утворити інший елемент)
P Li U O Rib
![]() фосфор літій уран оксисен рубідій флуор
фосфор літій уран оксисен рубідій флуор
![]()
![]()
![]()


входить до лужний радіоактив. найпоширеніший 5 енергет.рівнів
складу кісток метал елемент, неметал на плане- на зов. - 1 електрон
(у якого елемента II періоду назва ті, входить до
немет. властив. планети складу оксидів
 виражені сильніше
виражені сильніше
Si чи P)
4. Випереджальне домашнє завдання (учні розповідають цікаву інформацію про хімічні елементи)
5. Загадки (відгадки записуються на дошці)
S, O, N, С, Mg, F, Ne, H
Я елемент у шостій групі,
Займаю головну підгрупу.
На долар я схожий,
До складу трьох кислот я вхожу. (S) сульфур
 Я живу в квартирі вісім,
Я живу в квартирі вісім,
Як з’являється хтось лишень
Вмить оксиди виникають
Я інертників минаю. (O) оксиген
Я елемент усім відомий,
В повітрі майже невагомий,
Мене рослини полюбляють,
На номер схожий – всі це знають. (N) нітроген
Шість нейтронів у ядрі –
Особливості мої.
Це підказка. Відгадайте,
Як зовуть мене пізнайте. (C) карбон
Дюжину протонів маю,
Другу групу полюбляю
Відгадайте хто я є.
Як звучить ім’я моє? (Mg) магній
Оксигену не боюся
І йому не підкорюся.
Силу я найбільшу маю
Електрон завжди шукаю. (F) флуор
Елемент я незвичайний
І поводжуся нейтрально,
Період другий завершаю
А гелій за брата маю. (Ne) неон
Я найлегший елемент,
Електрон – мій аргумент.
Чи прийняти чи відняти?
Це мене треба писати
Бо вирішую все я –
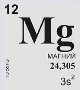 Особливість в цім моя. (H) гідроген
Особливість в цім моя. (H) гідроген
- Який елемент зайвий в даному ряду ? (магній)
- Чому? (всі - неметали, магній – метал)
V. Фізкультхвилинка
(вчитель показує хімічний елементи – учні визначають:
метал – підняти руки
неметал – хлопати
VI.Закріплення
- Скласти сенкан з теми «Хімічні елементи»
1 іменник
2 прикметника
3 дієслова
фраза
1 слово
- Робота з періодичною системою (за стислим описом визначити хімічний елемент і на таблиці зробити наклеювання папірця)
Li – цей хімічний елемент має заряд ядра +3
C – має 6 електронів
Ca – елемент 4 періоду , II групи, головної підгрупи
Al – найпоширеніший метал, елемент III групи
Cu – цей елемент утворює просту речовину – мідь
Mg – електронна формула 1s2 2s2 2p6 3s2
Sc – протонне число +21
Ge – відносна атомна маса дорівнює 73

VII.Домашнє завдання
ст. 152 – 155 читати
ст. 156 №8 письм.


про публікацію авторської розробки
Додати розробку
