Урок на тему"Кислоти.Фізичні властивості."
Тема. Кислоти, їх склад, назви та класифікація, фізичні властивості. Поширеність у природі та використання. Вплив на довкілля і здоров'я людини.
Дата___________
Урок 42
Тема. Кислоти, їх склад, назви та класифікація, фізичні властивості. Поширеність у природі та використання. Вплив на довкілля і здоров’я людини.
Мета: сформувати поняття про кислоти, визначити особливості їх складу та назв, порівняти кислоту за складом та ознайомити з класифікацією кислот, розглянути фізичні властивості і поширення їх у природі; розвивати вміння порівнювати та систематизувати сприяти розвитку творчого мислення комунікативних вмінь, грамотної хімічної мови..
Тип уроку: комбінований.
Форми роботи: робота з підручником, розповідь вчителя, гра "Пасьянс", метод "Мікрофон".
Обладнання та матеріали: таблиця "Кислоти", підручник
Хід уроку
I. Організаційний етап.
II. Основна частина уроку.
2.1. Актуалізація опорних знань.
1. Інтерактивна вправа "Мікрофон"
> Які речовини називаються складними?
> Які складні речовини ви знаєте?
> Які речовини називаються оксидами?
> На які групи поділяються оксиди?
> Які оксиди називаються основними? кислотними?
2. Хімічний диктант
1. натрій оксид 6. магній оксид
2. карбон(П) оксид 7. ферум(III) оксид
3. СаО 8. S03
4. карбон(ІУ) оксид 9. К20
5. S02 10.кальцій оксид
11 .літій оксид 12.барій оксид
III. Вивчення нового матеріалу Розповідь учителя
Продовжуємо мандрівку дивною та загадковою країною Хімія. Ми вже зробили перші кроки, щоб проникнути в її таємниці. Сьогодні ми познайомилися з одним з основних класів неорганічних сполук, назву якого ви довідаєтеся, якщо виконаєте такі завдання.
До кожного типу хімічних реакцій потрібно віднести рівняння, наведене в таблиці 1. У відповідній графі підкресліть літеру, і якщо ви правильно відповісте, то визначите клас неорганічних речовин, який ми з вами будемо вивчати.
Таблиця 1
|
Рівняння реакцій |
|
Реакції |
|
|
сполучення |
розкладання |
заміщення |
|
|
СаСО3 = СаО + СО2 |
м |
к |
а |
|
2Na + Cl2 = 2NaCl |
и |
О |
н |
|
Zn + H2SО4 = ZnSО4 + Н2 |
є |
Р |
с |
|
2Н2+О2 = 2Н2О |
л |
Д |
ю |
|
Cu(OH)2 = CuO + H20 |
ф |
о |
X |
|
wo3 + 3H2 = w + 3н2о |
б |
в |
т |
|
2Ca + О2 = 2CaO |
и |
Г |
ж |
Так, ви правильно визначили. Тема сьогоднішнього уроку — «кислоти». Ми ознайомимося зі складом кислот, їх класифікацією, фізичними властивостями.
„Мозковий штурм”.
Що спільного між лимоном, томатом, квашеною капустою, щавлем і кефіром? (кислий смак)
Чому від кропиви подразнення шкіри? ( до складу соку входить кислоти)
Чому чай після додавання лимону світлішає? (кислота змінює забарвлення)
Чому кефір, ряжанка, сметана, простокваша відноситься до молочно – кислих продуктів? ( до їх складу входить молочна кислота)
З представниками класу кислот ви знайомі з дитинства. Ми з вами можемо навести багато таких прикладів з нашого досвіду.
Отже, як ви вважаєте, чому цей клас неорганічних сполук названий кислотами? (Учні відповідають.) Так, ви праві, переважно кислоти кислі на смак.
Яким же є склад кислот?
З представниками цих речовин ми з вами познайомилися, коли вивчали властивість води вступати у взаємодію з кислотними оксидами.
Погляньте на дошку, там ми сьогодні з вами записали рівняння реакцій:
СО2+Н2О = Н2СО3 SO2+H2O - H2SO3
S03+H20 = H2S04 N205+H20 = 2HN03
Учні відповідають на запитання:
1) Що утворилося в результаті цих реакцій?
2) Що спільного мають формули кислот?
Учитель підбиває підсумки, дає визначення поняттям «кислотний залишок», «кислота».
Робота з таблицею
Перед вами таблиця 2. Заповніть її до кінця, поставте формули кислотних залишків та їх валентність.
Розповідь учителя
Сучасні назви кислот — сульфатна, фосфорна, карбонова — вперше були запропоновані французькими хіміками Лавуазье, Бертолле, Фуркуаї де Морво.
У 1792 р. Лавуазье у своїй доповіді Паризькій академії наук від імені всіх хіміків сказав: «Для назв різних кислот ми завжди брали похідне від позначень вихідного елемента. Так, кислоту, отриману із сірки, ми назвали сульфатною кислотою замість купоросної, з вугілля — карбонатною замість повітряної».
Таблиця 2
|
Назва кислоти |
Формула кислоти |
Кислотний залишок |
Валентність |
|
Хлорводнева кислота |
HCl |
|
|
|
Бромводнева кислота |
НВг |
|
|
|
Флуороводнева кислота |
HF |
|
|
|
Нітратна кислота |
HNO3 |
|
|
|
Сульфатна кислота |
H2SO4 |
|
|
|
Карбонатна кислота |
Н2С03 |
|
|
|
Фосфорна кислота |
Н3Р04 |
|
|
|
Сірководнева кислота |
н2 |
|
|
А в Росії ці назви стали використовувати лише через 100 років. Хоча ще довгий час обговорювалося питання про назви: вчені намагалися дати такі назви, щоб сполучення слів нагадували російські прізвище й по батькові. Наприклад, для хлоридної кислоти пропонувалося – „водень хлорович”, а для сульфатної – „водень сіркович читирикислов”
І.Класифікація кислот
Учитель. Подивіться на дошку. Я розподілила кислота на дві групи.
НС1 HNO3
H2S H3PO4
НВг H2S04
Питання класу
Чим відрізняються ці групи кислот?
Учитель. Подивимося на другу таблицю. Тут усі кислоти розподілені на три колонки. Що було взято за основу для цієї класифікації?
HN03 H2S н3ро4
HCl H2SO4
НВr Н2CO3
Складаємо схему класифікації кислот:
![]()
![]()
![]() КИСЛОТИ
КИСЛОТИ
![]()
![]()
За складом За кількістю атомів Гідрогену
Оксигеновмісні Одноосновні
Безоксигенові Двоосновні
Трьохосновні
2. Фізичні властивості кислот
Робота з підручником.ст.160.
Учні складають таблицю.
Таблиця З
|
Кислоти |
Фізичні властивості |
||
|
агрегатний стан |
колір |
запах |
|
|
HCl |
|
|
|
|
HN03 |
|
|
|
|
h2so4 |
|
|
|
|
н3ро4 |
|
|
|
2) Правила техніки безпеки й заходи першої медичної допомоги під : роботи з кислотами (повторити)
► Розповідь учителя
Кислоти відносяться до їдких речовин. При потраплянні на шкіру І або слизові оболонки з'являються хімічні опіки, а при потраплянні концентрованої сульфатної кислоти — навіть обвуглювання шкіри. (Демонстрація. Обвуглення паперу концентрованою сульфатною кислотою.) При потраплянні на одяг з'являються дірки: одразу або після прання (в залежності від кількості кислоти). Тому з кислотами, особливо з концентрованими треба поводитися вкрай обережно. Працювати з ними бажано в гумових рукавичках. Якщо кислота випадково потрапила на шкіру, її треба негайно змити великою кількістю проточної води, а потім при необхідності змочити ушкоджену ділянку шкіри слабким розчином соди.
При розчиненні концентрованих кислот у воді виділяється велика і кількість теплоти. Якщо наливати воду в склянку з концентрованою кислотою, то вода збирається на поверхні (густина концентрованих кислот більша за воду) і під дією теплоти, що виділяється при розчинені може закипіти і починати розбризкуватись. Тому при розбавленні концентрованих кислот обов’язково треба наливати тільки кислоту у склянку з водою, а не навпаки.
навпаки.
3. Поширення та застосування кислот
|
Хлоридна (HCl) |
Для добування хлоридів металів, у шкіряній промисловості, лудильній і паяльній справах; відіграє важливу роль у процесі травлення, за зниженої кислотності рекомендується пити розбавлені розчини кислоти перед вживанням їжі |
|
Фторидна (HF) |
Для витравлювання на склі візерунків, написів, щоб надати скляним предметам матової поверхні (лампочки) У виробництві барвників, мастил і пластичних мас; при добуванні високоякісних бензинів |
|
Сульфатна (H2S04) |
«Хліб хімії». Немає жодної галузі хімічної промисловості, де не застосовували б сульфатну кислоту. У виробництві мінеральних добрив, для добування кислот, у виробництві барвників фарб, пластичних мас, в органічному синтезі. В нафтохімічній промисловості, кольоровій металургії, у виробництві вибухових речовин, штучного волокна, харчовій промисловості |
|
Нітратна (HN03) |
Завдяки здатності розчиняти різні метали і неметали широко використовується для окиснення простих речовим У виробництві азотних добрив. При виготовленні барвників, лікарських препаратів, вибухівки, штучного волокна. У ракетній техніці, як реактив окисник у хімічних лабораторіях |
IV. Узагальнення й закріплення знань
Фронтальна бесіда:
1. Які речовини ми будемо називати кислотами?
2. Що таке кислотний залишок і як визначити його валентність?
3. За якими ознаками можна класифікувати кислоти?
4. Яких правил техніки безпеки слід дотримувати під час роботи І кислотами?
5. Уявіть, що крапелька кислоти раптом потрапила вам на шкіру руки. Ваші перші дії? ,
Гра «Пасьянс»
На столи учнів даються картки, необхідно скласти формули кислот, наприклад:
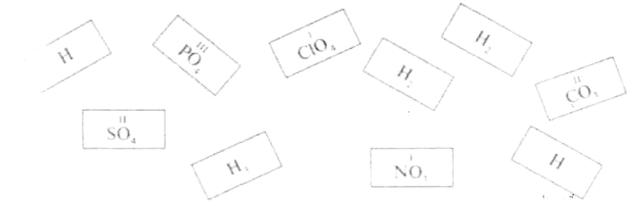
Гра «Хто зайвий?»
У кожному ряді знайдіть зайву кислоту та вкажіть, за яким принципом ви це визначили.
1) H2S, Н2СОз, Н3РО4, H2S04, H2SO3.
2) HN03, HCl, HBr, HI, HF.
3) Н2СОз, H2SО4, HNO3, H2SО3, H2Si03.
Задачі
1. Обчисліть масову частку (в %) Оксигену в ортофосфорній кислоті.
2. Якою є маса 1,2 • 1023 молекул ортофосфорної кислоти?
V. Заключна частина уроку
5.1. Підбиття підсумків роботи на уроці
5.2. Домашнє завдання
§ 32; вивчити назви кислот.
Скласти казку про кислоти


про публікацію авторської розробки
Додати розробку
