Хімічні властивості кислот
Талалаїваська загальноосвітня школа І-ІІІ ступенів
Талалаївської селищної ради
Розробка уроку хімії у 8 класі
Хімічні властивості кислот
(навчальна пара-2 уроки)
Підготувала
учитель хімії
Талалаївської ЗОШ І-ІІІ ступенів
Михно С.В.
2019 рік
Мета:
- з’ясувати хімічні властивості кислот;
- сформувати уявлення про індикатори, витискувальний ряд металів;
- розвивати навички складання рівнянь хімічних реакцій на прикладі хімічних властивостей кислот;
- з’ясувати суть реакції обміну на прикладі взаємодії кислот з оксидами металів;
- ознайомити учнів із галузями використання кислот;
- продовжити роботу над закріпленням правил техніки безпеки під час роботи з кислотами;
- показати тісний взаємоз’вязок хімічних знань з життям;
- розвивати логічне та образне мислення учнів, пам’ять, уяву, уміння порівнювати, узагальнювати, виділяти головне;
- виховувати інтерес до хімії.
Тип уроку: формування вмінь і навичок, урок-дослідження.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності кислот, основ, солей, ряд активності металів, плакат «Правила техніки безпеки в кабінеті хімії», мультимедійна презентація хімічні прилади пробірки, картки з формулами кислот спиртівка, пробіркотримач, сірники.
Реактиви: розчини сульфатної, хлоридної та лимонної кислот, індикатори: лакмус, метилоранж, фенолфталеїн, універсальний; магній, мідь, купрум (ІІ) оксид.
Методи: інтерактивні методи навчання: робота у групах, ігри “Хімічне доміно”, «3 зайвий», «Хрестики-нулики», «Хімічне ліплення»
Форми роботи: розповідь учителя, лабораторні досліди, робота з опорною схемою, робота з підручником.
ДЕВІЗ УРОКУ:
Практика без теорії сліпа,
теорія без практики мертва.
Кожна гіпотеза тільки тоді стає теорією,
коли вона перевірена практикою.
ХІД УРОКУ
І Привітання. Організація класу до уроку.
ІІ Пропедевтична практика
1. Яку загальну тему зараз вивчаємо? (класи неорганічних сполук)
2. З якими новими поняттями зустрілися при вивченні даної теми? Словникова робота. ( солетворні оксиди, несолетворні оксиди, основи, кислоти, солі,…) Хімічний ланцюжок-(діти називають поняття і записують в стопчик на дошці. По черзі дають визначення).
3. Які класи неорганічних сполук ви знаїте?
4. Про які класи неорганічних речовин ми говорили детальніше. (оксиди, основи, кислоти-частково)
5. Яка інформація є у вас про кислоти?
Слайд мультимедійної презентації
Вставити слова, формули.
- Сполука, молекула якої містить один чи декілька атомів Гідрогену, здатних під час хімічних реакцій заміщуватися на атоми … елемента.
(Кислота)
-За вмістом Оксигену кислоти поділяють на …
(Оксигеновмісні та безоксигенові)
-Загальна формула оксигеновмісних кислот …
(НхЕОу)
-Загальна формула безоксигенових кислот …
(НnЕ)
-Для кожної оксигеновмісної кислоти існує відповідний оксид, його називають …
(Кислотним оксидом)
-Частину молекули кислоти, сполучену з атомом Гідрогену, називають …
(Кислотним залишком)
-Кількість атомів Гідрогену в молекулі кислоти визначає …
(Валентність кислотного залишку)
-Елемент, що утворює кислоту, називають …
(Кислототворним)
-Кількість атомів Гідрогену в молекулі кислоти називають …
(Основністю)
Допоможіть юному хіміку заповнити таблицю
|
Кислоти |
||||
|
Одноосновні |
Двохосновні |
Трьохосновні |
Оксигеновмісні |
Безоксигенові |
|
|
|
|
|
|
А тепер давайте проведемо гру “Хрестики-нулики”
Таблиця- пустографка зображена на плакаті, або дошці.
Слайд мультимедійної презентації
Виграшний шлях – формули оксигеновмісних кислот.
|
HCl |
HNO3 |
H3PO4 |
|
H2SiO3 |
H2SО3 |
HBr |
|
H2SO4 |
H2CO3 |
HI |
Слайд мультимедійної презентації
Гра “Третій зайвий” (визначте в переліку зайву речовину і вкажіть ознаку, за якою вона відрізняється від інших)
- HCl, H2S, Н2О
- H2Se, H2CO3, H2SO4
- HBr, HCl, H2SO3
- HPO3, HClO4, H3PO4
HNO2, HIO3, HBr
ІІІ . Орієнтація
Як ви думаєте, чи достатньо вам знань про кислоти, одержаних на попередніх уроках ? Як кислоти поводять себе із речовинами інших класів? З якими речовинами взаємодіють? Чи можите дати відповідь на ці питання зараз?
ІV. Презенація нового матеріалу.
Запис теми уроку. Хімічні властивості кислот
Визначення завдань уроку ( разом із учнями)
Визначити деякі властивості речовин можна через досліди
Групова робота. Групи: Індикатори. Метали.
Виконання дослідів , різних для кожної групи з послідуючою презентацією.
Пригадуємо. Правила поводження з кислотами.
У разі потрапляння кислоти на шкіру треба негайно змити її проточною водою до зникнення відчуття печії, потім промити розчином питної соди та звернутися до медпункту.
Слайд мультимедійної презентації
Пам’ятайте, всі кислоти
Не бувають без роботи
Все руйнують навкруги
Шкіру, одяг і луги.
Щоб не скоїли вам шкоду
Бережіть від них ви воду,
Обережним будь, обачним,
Бо помилки не пробачать
Агресивні і їдучі
Як вогонь вони пекучі.
Підкоряють навіть сплави,
Кислота - не для забави.
Для кислот характерні такі хімічні властивості:
- Дія розчинів кислот на розчини індикаторів.
Завдання для групи ІНДИКАТОРИ
Робота з підручником (сторіка-174).
Лабораторний дослід №4 . Дія водних розчинів кислот на індикатори
У три пробірки налийте по 1-2 мл розчину хлоридної кислоти. В одну пробірку додайте 1-2 краплі лакмусу, в другу – розчин фенолфталеїну, а в третю – розчин метилоранжу. Що спостерігаєте? Як змінюється забарвлення індикаторів?
Слайд мультимедійної презентац
Лакмус: Лакмус фіолетовий
Кислоти соромиться,
Як потрапить в її розчин
Вмить червоним робиться.
Слайд мультимедійної презентації
Метилоранж: І метил оранжевий
З кислотами не дружить,
Він стає рожевим,
Пам’ятай це, друже.
Слайд мультимедійної презентації
Фенолфталеїн: Фенолфталеїн єдиний
Кислот не боїться,
Яким був собі безбарвним,
Таким і лишиться.
Брильянтовий зелений – стає оранжевим.
Зробіть висновок. Яким індикатором не можна виявити кислоту? (Фенолфталеїном)
Пригадаємо. Які речовини називаємо індикаторами?
Індикаторами називають речовини, які змінюють своє забарвлення під дією розчину кислоти або лугу. До найбільш розповсюджених індикаторів відносять лакмус, метиловий оранжевий, фенолфталеїн та універсальний індикаторний папір. У розчині кислоти лакмус, метиловий оранжевий та універсальний індикаторний папір матимуть червоне забарвлення, а фенолфталеїн залишиться безбарвним.
Завдання для групи МЕТАЛИ
- Взаємодія кислот з металами з утворенням солі та водню.
Робота з підручником (сторіка-175).
Лабораторний дослід № 5 Взаємодія хлоридної кислоти з металами
Візьміть три пробірки. У першу пробірку помістіть 2-3 шматочки цинку, у другу – трошки порошку магнію, а у третю – 2-3 шматоки мідної дротини. До кожної пробірки долийте 2-3 мл хлоридної кислоти. Чи усі метали взаємодіють із кислотою? Порівняйте активність металів. Складіть рівняння реакцій
Слайд мультимедійної презентації
Усі кислоти, щоб ви знали,
Закохалися в метали.
Не у всі, а лише в ті,
Що під силу кислоті.
Ось погляньте на цей ряд,
Там метали всі стоять,
Гідроген між ними є,
Нам підказку він дає:
З тими, що до Гідрогену,
У кислоти нема проблеми.
У заміщення вступає –
Водень з себе виганяє.
Сіль утвориться крім того –
Це запамятай ти строго.
Слайд мультимедійної презентації
Витискувальний ряд металів
Як ви розумієте заголовок слайду в порівнянні із табличкою?
Російським вченим М.М. Бекетовим на основі експериментальних дослідів був складений витискувальний ряд (ряд напруг) металів: Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Fe, Ni, Sn, Pb, (H2), Cu, Hg, Ag, Pt, Au.
У цьому ряді всі метали, що стоять до водню H2, витискують Гідроген H із розчинних кислот (крім нітратної кислоти HNO3). Отже, кислоти (крім HNO3) взаємодіють із металами, які розташовані в ряді напруг до водню, з утворенням солі та водню:
Mg + 2HCl = MgCl2 + H2
До якого типу хімічних реакцій віднесемо такі реакції?
Реакції такого типу, які відбуваються за участю простої та складної речовини, і в результаті яких утворюється проста та складна речовина називаються реакціями заміщення.
3.Взаємодія кислот з основними оксидами з утворенням солі та води:
Віртуальний дослід (Відеоролик)
Na2O + H2SO4 = Na2SO4 + H2O
Слайд мультимедійної презентації
Із оксидами металів
У кислот проблем немає.
Реагують з усіма
Тут вже винятків нема.
А утвориться при цьому
Сіль і H2O – відомі.
Обміном назвем таку
Ми реакцію складну.
До якого типу хімічних реакцій віднесемо такі реакції?
Слайд мультимедійної презентації
Реакції, які відбуваються за участю двох складних речовин, які обмінюються складовими частинами, називаються реакціями обміну.
Слайд мультимедійної презентації
Потрібно запам’ятати:
Реакції обміну проходять до кінця у трьох випадках:
1) якщо внаслідок реакції утворюється вода;
2) якщо один із продуктів реакції випадає в осад;
3) якщо один із продуктів реакції є леткою (газоподібною) речовиною.
Для того, щоб визначити, чи є речовина нерозчинною, треба скористатися таблицею розчинності.
4.Взаємодія кислот з основами з утворенням солі та води:
Демонстрація вчителем досліду із залученням учнів.
KOH + HNO3 = KNO3 + H2O
Реакція обміну за типом і реакція нейтралізації по суті.
Слайд мультимедійної презентації
Реакцією нейтралізації називається реакція між кислотою та основою, внаслідок якої утворюється сіль та вода.
- Взаємодія кислот з солями з утворенням іншої солі та іншої кислоти.
Віртуальний дослід (Відеоролик)
K2SiO3 + H2SO4 = H2SiO3 + K2SO4
Слайд мультимедійної презентації
Відповідно до ряду активності кислот кожна попередня кислота витісняє наступну кислоту з її солі: утворюється нова сіль і нова кислота. Сіль не повинна бути важкорозчинна, а кислота сильніша за ту, яку добувають.
Опорні таблиці
Слайд мультимедійної презентації
Ряд активності кислот
|
HClO4, HNO3, HI, HBr, HCl, H2SO4, |
H2SO3, H3PO4, HF, HNO2, |
H2CO3, H2S, H2SiO3 |
|
сильні |
середні |
слабкі |
Слайд мультимедійної презентації
Деякі кислоти розкладаються на кислотний оксид і воду:
|
За нормальних умов |
H2CO3 = CO2 + H2O; |
|
Під час нагрівання |
4 HNO3 = 2H2O +4 NO2 + O2 |
|
Під час сильного нагрівання |
H2SіO3= SіO2 + H2O |
При роботі з кислотами треба бути дуже обережними. Під час розведення кислот необхідно приливати кислоту у воду невеликими порціями при перемішуванні, але не навпаки.
Слайд мультимеійної презентації
Спочатку вода,
Потім кислота.
Інакше - трапиться біда
Слайд мультимедійної презентації
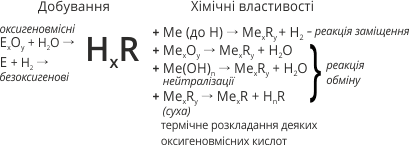
Слайд мультимедійної презентаці
Взаємозв’язок між класами неорганічних сполук
|
|
Основний оксид |
Кислота |
Основа |
Сіль |
|
Кислотний оксид |
сіль |
|
сіль |
|
|
Кислота |
сіль |
|
сіль |
нова сіль |
|
Основа |
|
сіль |
|
|
|
Сіль |
|
нова сіль |
нова сіль |
нові солі |
V. Практика на прикладах
Сьогодні центральною фігурою уроку є кислоти. Виділи їх серед інших сполук:( завдання на швидкість 2 учням)
Слайд мультимедійної презентації
І..Виділи кислоти серед інших сполук
а)N2O5, H2S, ZnO, H2SO3, KNO3, H2SiO3;
б)H2SO4, CuO, HI, SO3, H3PO4, NaCl.
(Завдання на мультимедійній дошці для кількох унів, що проводять записи на дошці).
Слайд мультимедійної презентації
ІІ.Запишіть хімічними рівняннями реакції нейтралізації ( 2 уч.)
Вибір завдання жеребкуванням.
а) цинк гідроксиду фосфатною кислотою;
б) калій гідроксиду плавиковою кислотою;
в) натрій гідроксиду хлоридною кислотою;
г) калій гідроксиду сульфідною кислотою.
Слайд мультимедійної презентації
ІІІ.“Хімічне ліплення” Групова робота (по 3 учні біля дошки). Для виконання завдання 3хв. Кожне завдання дає 2 додаткові бали кожному учню, який виконав. За перемогу команди додається ще по 1 балу кожному учню групи.
Команда «СПРИТНІ»
|
Формула кислоти |
Ag (I) |
Cu (II) |
Fe (III) |
|
HI |
|
|
|
|
H3PO4 |
|
|
|
Команда «УМІЛІ»
|
Формула кислоти |
Na |
Mg |
Fe (III) |
|
H2SO4 |
|
|
|
|
HCl |
|
|
|
Слайд мультимедійної презентації
І V.Є три набори речовин, які з них можна використати вчителю для пояснення уням хімічних властивостей кислот:
1) H2O і SO3;
2) HCl і ZnO;
3) HNO3 і SiO2.
VІ. Керована практика
Міні-турнір ЮНИХ ХІМІКІВ. (15хв)
Поділ класу на ІІ команди.
Умови турніру:
- Приз глядацьких симпатій- оцінка 12 балів
-Команда виставляє учасниківдля відповіді так, щоб кожний член команди відповідав , протягом гри
-Максимальна кількість балів за правильну відповідь 3
-До журі обираємо 3 учні, які були самими активними сьогодні на уроці
Завдання для команд
Слайд мультимедійної презентації
І. Дано метали: Fe, Ca, Ag, Cu. Які з цих металів взаємодіятимуть із сульфідною кислотою? Напишіть рівняння реакцій. (по 1 учаснику)
Слайд мультимедійної презентації
ІІ. Напишіть можливі рівняння реакцій між сульфатною кислотою й речовинами: BaO, Na2O, Cu, Ca(OH)2, O2, Na2SO3, H2O, Zn (по 1 учасники від команди)
Слайд мультимедійної презентації
ІІІ. Спрогнозуйте продукти реакцій у тих випадках, де вони можливі. Назвіть типи хімічних реакцій реакцій: (по 3 учасники від команди)
|
а) ZnO + HCl → … |
б) MgO + H3PO4 → … |
|
в) KOH + HCl → … |
г) NaOH + H2CO3 → … |
|
д) Cu + H2SO4 → … |
е) Na2SO4 + H2SO4 → … |
VIІ. Незалежна практика
(Учень виконує самостійно 1 завдання за вибором)
Слайд мультимедійної презентації
1.Внесіть у таблицю хімічні формули речовин замість знака питання так, щоб були приклади реакцій сполучення, заміщення, обміну.
|
? + H3PO4 → Na3PO4 + ?; |
H2SO4 + ? → CuSO4 + ?; |
|
HCl + ? → CuCl2 + ?; |
? + H2S → ZnS + H2O; |
|
Mg + ? → MgSO3 + ?; |
? + ? → Al2(SO4)3 + H2O; |
|
MgO + ? → MgSO4; |
? + ? → K2CO3. |
2.Чи є зв’язок між оксидами і зазначеними кислотами? Якщо є, то який? H3PO4, HNO3, H2SiO3, H2SO3, H2SO4.
3.Для проведення дослідів у розпорядженні лаборанта є тільки хлоридна кислота. Укажіть групу речовин, у якій усі речовини можна використати для підтвердження хімічних властивостей хлоридної кислоти:
а) H2O, H2, BaO;
б) Zn, H2O, BaSO4;
в) Fe, MgO, Na2S.
Підтвердіть хімічними рівняннями реакцій.
Які це властивості? Підтвердіть їх хімічними рівняннями.
4.Яка маса солі утвориться, якщо на 130 г. Цинку вилили хлоридну кислоту?
VIІІ. Самостійна домашня робота
Опрацювати матеріал підручника, виконати завдання за вибором( ст.177-180), та із наступних запропонованих:
1.На наступному уроці ми будемо вивчати солі, запропонуйте шляхи отримання таких солей, щоб можна було їх охарактеризувати. Li3PO4, SrSO4, AgNO3, AlOHCl2.
2. Чи можливо здійснити такі перетворення?
а) KClO3 → O2 → ZnO → ZnCl2;
б) Al → Al2O3 → AlCl3 → Al2(SO4)3;
в) H2O → O2 → CO2 → H2CО3
Для можливих перетворень зазначте тип хімічної реакції.


про публікацію авторської розробки
Додати розробку
