Хімічні властивості кислот. Ряд активності металів. Реакції заміщення і обміну.
Комунальний заклад
«Криворізький навчально-виховний комплекс
«Загальноосвітня школа І-ІІ ступенів –
дошкільний навчальний заклад» №18
Розробка уроку хімії у 8 класі
Хімічні властивості кислот.
Ряд активності металів.
Реакції заміщення і обміну.
|
|
Підготував учитель хімії Криворізького НВК №18 Шаврін О.С.
|
Кривий Ріг
2020
Мета:
- познайомити учнів з хімічними властивостями кислот, наголосити на правилах т/б під час поводження з кислотами; розвивати вміння складати формули, рівняння реакцій;
- розвивати логічне мислення та усне мовлення, уміння аналізувати, зіставляти, робити висновки;
- виховувати інтерес до вивчення хімії на основі хімічного експерименту.
Ціль уроку та вимоги до учня:
-розрізняє реакції заміщення, обміну, нейтралізації;
-характеризує фізичні та хімічні властивості кислот;
-встановлює генетичні зв’язки між простими і складними речовинами, основними класами неорганічних сполук;
-обґрунтовує залежність між складом, властивостями та застосуванням речовин;
-прогнозує перебіг хімічних реакцій кислот з металами, використовуючи ряд активності;
-складає рівняння реакцій, які характеризують хімічні властивості кислот (взаємодія з металами, основними оксидами, основами та солями); способи добування кислот (взаємодія кислотних оксидів із водою, неметалів із воднем, солей із кислотами;
-використовує таблицю розчинності кислот, основ та солей для складання рівнянь хімічних реакцій; індикатори для виявлення кислот ;
-планує експеримент, проводить його, описує спостереження, робить висновки;
-розв’язує експериментальні задачі;
-оцінює значення найважливіших представників основних класів неорганічних сполук;
-дотримується запобіжних заходів під час роботи з кислотами .
Тип уроку: Комбінований урок. Формування вмінь і навичок. Урок-дослідження.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності кислот, основ, солей, ряд активності металів, мультимедійна презентація, хімічні прилади пробірки, картки з формулами кислот спиртівка, пробіркотримач, сірники.
Реактиви: розчини сульфатної, хлоридної та лимонної кислот, індикатори: лакмус, метилоранж, фенолфталеїн, універсальний; магній, мідь, купрум (ІІ) оксид.
Методи: інтерактивні методи навчання: робота у групах, ігри “Хімічне доміно”, «3 зайвий», «Хрестики-нулики», «Хімічне ліплення»
Форми роботи: розповідь учителя, лабораторні досліди, робота з опорною схемою, робота з підручником.
Девіз уроку:
Практика без теорії сліпа,
теорія без практики мертва.
Кожна гіпотеза тільки тоді стає теорією,
коли вона перевірена практикою.
Хід уроку.
1. Організаційний момент.
Взаємне вітання вчителя й учнів, організація уваги та психологічне налаштування учнів на продуктивну роботу.
2. Мотивація навчальної діяльності.
3. Актуалізація опорних знань.
1. Яку загальну тему зараз вивчаємо? ( неорганічні сполуки)
2. На які класи розділяють неорганічні сполуки?( оксиди, кислоти, основи, солі.)
2. Як класифікують основні класи?
( солетворні оксиди, несолетворні оксиди, основи, кислоти, солі,…)
4. Про які класи неорганічних речовин ми говорили детальніше. (оксиди, основи, кислоти)
5. Яка інформація є у вас про кислоти?
Учні малюють таблицю на дошці.
Вставити слова, формули.
- Сполука, молекула якої містить один чи декілька атомів Гідрогену, здатних під час хімічних реакцій заміщуватися на атоми … елемента.
(Кислота)
-За вмістом Оксигену кислоти поділяють на …
(Оксигеновмісні та безоксигенові)
-Загальна формула оксигеновмісних кислот …
(НхЕОу)
-Загальна формула безоксигенових кислот …
(НnЕ)
-Для кожної оксигеновмісної кислоти існує відповідний оксид, його називають …
(Кислотним оксидом)
-Частину молекули кислоти, сполучену з атомом Гідрогену, називають …
(Кислотним залишком)
-Кількість атомів Гідрогену в молекулі кислоти визначає …
(Валентність кислотного залишку)
-Елемент, що утворює кислоту, називають …
(Кислототворним)
-Кількість атомів Гідрогену в молекулі кислоти називають …
(Основністю)
Гра “Третій зайвий” (визначте в переліку зайву речовину і вкажіть ознаку, за якою вона відрізняється від інших)
- HCl, H2S, Н2О
- H2Se, H2CO3, H2SO4
- HBr, HCl, H2SO3
- HPO3, HClO4, H3PO4
- HNO2, HIO3, HBr.
заповнити таблицю:
|
Одноосновні кислоти |
Двохосновні кислоти |
Оксигеновмісні кислоти |
Безоксигенові кислоти |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Виграє той хто більше записав кислот на дошці.
4. Вивчення нового матеріалу.
Кислоти - їдкі речовини, тому поводитися з ними слід обережно: оком не змигнеш - з'їдять не лише мертву, але й живу тканину.
1. Уважно читайте етикетки на склянках.
2. Речовини для дослідів беріть не більше 1 - 2 мл. (наливайте обов'язково над лотком!).
3. Не залишайте склянки з кислотами відкритими.
4. Не виливайте залишки реактивів з пробірки назад у склянку, з якої він був узятий.
5. Якщо випадково кислота потрапила на руки чи на одяг - негайно змийте її великою кількістю води, нейтралізуйте розчином соди і знову змийте водою.
6. Якщо потрібно розбавити сульфатну кислоту, пам'ятайте правило:
«Спочатку вода,
Потім кислота.
Інакше - трапиться біда!»
7. Категорично забороняється проводити досліди, не зазначенні в роботі, та самостійно зливати та змішувати реактиви.
1. Поняття про витискувальний ряд металів.
У багатьох хімічних реакціях беруть участь прості речовини, зокрема метали. Метали можуть взаємодіяти з усіма класами неорганічних сполук, що вивчаються в школі. Однак різні метали проявляють різну активність в хімічних взаємодіях, і від цього залежить, чи буде реакція перебігати чи ні. Чим більша активність металу, тим енергійніше він реагує з іншими речовинами. За активністю всі метали можна розташувати у ряд, який називається рядом активності металів, або витискувальним рядом металів, або рядом напруг металів, а також електрохімічним рядом напруг металів.
Цей ряд вперше вивчив видатний учений М. М. Бекетов, тому цей ряд ще має назву ряду Бекетова.
Ряд активності металів Бекетова має наступний вигляд (наведено
найбільш уживані метали):
K> Ca > Na >Mg > Zn > Fe > Ni > Sn > Pb > H2 > Cu > Hg > Ag > Au
У цьому ряді метали стоять за зменшенням їхньої активності. Отже серед наведених металів найбільш активним є калій, а найменш активним — золото. За допомогою цього ряду можна виявити, який метал є активнішим за інший. Також в цьому ряді присутній водень. Звичайно, водень не є металом, але в цьому ряді його активність прийнята за точку відліку (своєрідний нуль).
2. Взаємодія кислот з металами
Розповідь учителя
Перед вами на дошці — ряд напруг металів. Ми вже знайомилися зі зміною хімічної активності в цьому ряді, коли вивчали властивості води. Метали, що розташовані в ряді активності до Гідрогену, будуть вступати в реакцію з кислотами. Як же буде проходити ця реакція? Що утвориться в результаті хімічної реакції? Подивіться на рівняння реакції та зробіть прогноз:
Zn + HCl →
Mg + H2SО4 →
реакції проходять за типом реакції заміщення, пояснюю чому й що буде утворюватися в результаті хімічної реакції.
А тепер подивимося, чи справді саме так будуть проходити хімічні реакції.
Демонстрація відео досліду.
Zn + 2HC1 = ZnCl2 + H2↑
Mg + H2SО4 = MgSО4 + H2↑
Cu + HСl →
Чому мідь не вступила в реакцію з розчином хлоридної кислоти?
Оформіть результати досліду в таблицю:
|
Метал |
Виділення водню, енергійність |
Рівняння хімічної реакції |
|
Mg |
Енергійність більше, ніж в другому досліді |
Mg + 2HCl = MgCl2 + H2 |
|
Zn |
Виділення водню |
Zn + 2HCl = ZnCl2 + H2 |
|
Cu |
Водень не виділяється |
Cu + HCl |
Реакції заміщення — це реакції, в яких атом одного елемента простої речовини витискує атоми іншого елемента зі складної речовини.
При взаємодії нітратної кислоти з металами, незалежно від концентрації кислоти, водень майже не виділяється, а виділяються інші продукти реакції, склад яких ви будете вивчати в наступних класах.
1.Сполучення: А + В → С C + O2 → CO2
2. Розкладу: А → В + С 2HgО → 2Hg + O2
3. Заміщення: А + ВС → АС + В Mg + 2HCl→MgCl2+H2↑
4. Обміну: АВ+СD→АD+ВС NaOH+HCl→NaCl+H2O
Реакція заміщення – це реакції, під час яких атоми простої речовини заміщають атоми одного з елементів складної речовини. 2Al + Fe2O3 → Al2O3 + Fe Елемент, яким утворена проста речовина, має бути активнішим, ніж той, що входить до складу складної речовини.
Реакції обміну – це реакції, в яких дві сполуки обмінюються своїми складовими частинами. ZnO + H2SO4 → ZnSO4 + H2O
Результатом реакції обміну є:
Випадання осаду (↓) – нерозчинні речовини. 2. Виділення газу (↑) – H2S↑, H2CO3 (CO2↑+ H2O), H2SO3 (SO2↑ + H2O), NH4OH ( NH3↑ + H2O). 3. Утворення води.
Бесіда
1. Яку інформацію несе витискувальний ряд металів Бекетова?
2. Як метали «розчиняються» у кислоті? Що при цьому утворюється?
3. Які метали здатні витискувати водень з кислот?
Виконання вправ
- Закінчіть рівняння реакцій, які можливі:
Fe + Н3РО4 → Са + НС1 →
Cu + HNО3 → Hg + H2SО4 →
- Шматочки магнію та цинку помістили у розчин хлоридної кислоти. В якому випадку реакція відбувається інтенсивніше?
Основні хімічні властивості кислот:
1Взаємодія кислот з основними оксидами з утворенням солі та води:
Віртуальний дослід.
Na2O + H2SO4 = Na2SO4 + H2O
До якого типу хімічних реакцій віднесемо такі реакції?
Реакції, які відбуваються за участю двох складних речовин, які обмінюються складовими частинами, називаються реакціями обміну.
Потрібно запам’ятати:
Реакції обміну проходять до кінця у трьох випадках:
1) якщо внаслідок реакції утворюється вода;
2) якщо один із продуктів реакції випадає в осад;
3) якщо один із продуктів реакції є леткою (газоподібною) речовиною.
Для того, щоб визначити, чи є речовина нерозчинною, треба скористатися таблицею розчинності.
2.Взаємодія кислот з основами з утворенням солі та води:
Демонстрація вчителем досліду із залученням учнів.
KOH + HNO3 = KNO3 + H2O
Реакція обміну за типом і реакція нейтралізації по суті.
Слайд мультимедійної презентації
Реакцією нейтралізації називається реакція між кислотою та основою, внаслідок якої утворюється сіль та вода.
3.Взаємодія кислот з солями з утворенням іншої солі та іншої кислоти.
Віртуальний дослід (Відеоролик)
K2SiO3 + H2SO4 = H2SiO3 + K2SO4
Відповідно до ряду активності кислот кожна попередня кислота витісняє наступну кислоту з її солі: утворюється нова сіль і нова кислота. Сіль не повинна бути важкорозчинна, а кислота сильніша за ту, яку добувають.
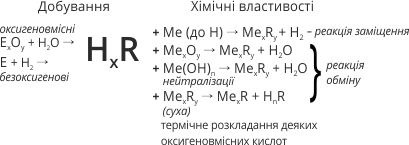
4.Деякі кислоти розкладаються на кислотний оксид і воду:
|
За нормальних умов |
H2CO3 = CO2 + H2O; |
|
Під час нагрівання |
4 HNO3 = 2H2O +4 NO2 + O2 |
|
Під час сильного нагрівання |
H2SіO3= SіO2 + H2O |
5 ПАКТИЧНІ ЗАВДАННЯ.
І..Виділи кислоти серед інших сполук
а)N2O5, H2S, ZnO, H2SO3, KNO3, H2SiO3;
б)H2SO4, CuO, HI, SO3, H3PO4, NaCl.
І. Дано метали: Fe, Ca, Ag, Cu. Які з цих металів взаємодіятимуть із сульфідною кислотою? Напишіть рівняння реакцій. (по 1 учаснику)
ІІ. Напишіть можливі рівняння реакцій між сульфатною кислотою й речовинами: BaO, Na2O, Cu, Ca(OH)2, O2, Na2SO3, H2O, Zn (по 1 учасники від команди)
ІІІ. Спрогнозуйте продукти реакцій у тих випадках, де вони можливі. Назвіть типи хімічних реакцій реакцій: (по 3 учасники від команди)
|
а) ZnO + HCl → … |
б) MgO + H3PO4 → … |
|
в) KOH + HCl → … |
г) NaOH + H2CO3 → … |
|
д) Cu + H2SO4 → … |
е) Na2SO4 + H2SO4 → … |
6. Підведення підсумків уроку.
Бесіда:
• Що ми сьогодні вивчили на уроці?
• Що нового ви дізналися про кислоти?
• Яких правил ТБ слід дотримуватися при роботі з кислотами?
• З якими речовинами реагують кислоти?
7. Самостійна домашня робота
Опрацювати матеріал підручника, виконати завдання за вибором( ст.177-180), та із наступних запропонованих


про публікацію авторської розробки
Додати розробку
