Урок хімії 8 клас на тему: «Йони. Йонний зв'язок, його утворення».
УРОК ХІМІЇ
8 клас
на тему:
«Йони. Йонний зв'язок, його утворення».
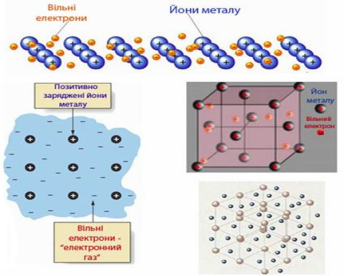
Тема Йони. Йонний зв'язок, його утворення.
Цілі:
- Формування ключових компетентностей:
- саморозвитку й самоосвіти створення проблемних ситуацій, уміння розв'язувати завдання;
- інформаційної вміння робити короткий раціональний запис, робити висновки та уагальнення;
- комунікативної – вміння працювати в парах.
- Формування предметних компетентностей: закріпити поняття ковалентного зв'язку, механізм його утворення, його види, поняття «диполь», розвивати поняття «електронегативність»; набути навичок складання електронних і структурних формул будови молекул; розкрити механізм утворення йонного зв'язку та йонів; виховувати вміння
виділяти головне, актуалізувати, конспектувати, порівнювати, зіставляти.
Тип уроку: засвоєння нових знань.
Обладнання: періодична система, таблиці «Види хімічного зв'язку», «Види кристалічних граток», «Електронегативність».
Девіз: Хімік без знання фізики подібний до людини, яка все шукати повинна на дотик.
(М.В.Ломоносов)
Хід уроку
І. Організаційний момент
Взаємне вітання вчителя та учнів. Повідомлення теми уроку. Перевірка домашнього завдання.
ІІ. Актуалізація і корекція опорних знань учнів
Клас розбивається на шість варіантів. З кожного варіанта викликається до дошки по одному учню.
Завдання для кожного варіанта
Визначте тип зв’язку та напишіть схему утворення сполук:
1)СН4; 2)F2; 3)Br2; 4) РН3; 5)SO2; 6)ССl4.
Учні самостійно аналізують роботу своїх товаришів, ставлять додаткові питання та оцінюють. Форма роботи – «учень-рецензент».
Самостійна робота
Варіант І
1. Дайте визначення поняттям:
а) ковалентний зв’язок;
б) ковалентний полярний зв’язок;
в) структурна формула;
г) диполь.
Куди зміщуються спільні пари електронів у ковалентному полярному зв’язку?
2. Який тип зв’язку в речовині N2? Складіть електронну та структурну формули.
3. Який тип зв’язку в речовині H2O? Складіть електронну та структурну формули.
4. Який тип зв’язку в речовині НСl? Складіть електронну та структурну формули.
5. Скільки електронів містить йон Na1+ ? Поясніть рішення.
6. Скільки електронів містить йон S2- ? Поясніть рішення.
Варіант ІІ
1. Дайте визначення поняттям:
а) хімічний зв’язок;
б) ковалентний неполярний зв’язок;
в) аніон;
г) електронна формула;
Як позначають спільні електронні пари у структурній формулі в ковалентному зв’язку?
2. Який тип зв’язку в речовині O2? Складіть електронну та структурну формули.
3. Який тип зв’язку в речовині H2S? Складіть електронну та структурну формули.
4. Який тип зв’язку в речовині NH3? Складіть електронну та структурну формули.
5. Скільки електронів містить йон Ca2+ ? Поясніть рішення.
6. Скільки електронів містить йон C1- ? Поясніть рішення.
ІІІ. Постановка завдань уроку
Сьогодні на уроці ми розглянемо зв’язок, який утворюється між елементами, які різко відрізняються електронегативністю. Це металічні й неметалічні елементи. Давайте згадаємо, що відбувається з електронами зовнішнього шару в елементів? Правильно, металічні елементи віддають електрони, а неметалічні їх приєднують
1. Розкрити суть йонного зв'язку.
2. Чим відрізняються за будовою атоми та йони.
3. Порівняти йонний та ковалентний зв'язок.
4. Виявити зв'язок між властивостями речовин та типом хімічного зв’язку.
ІV. Зіткнення учнів із проблемою й висловлення первинних гіпотез
1. Йони. Чим відрізняються атоми та йони?
А) Розглянемо будову атомів Na та Cl.
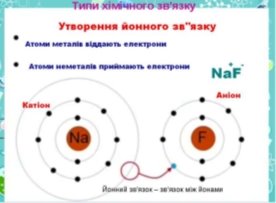
Na +11 2e- 8e- 1e- - 1е ------------------------ Na +11 2e- 8e- 0e-
(позитивний йон)
Cl +17 2e- 8e- 7e- + 1е ________________ Cl +17 2e- 8e- 8e-
(негативний йон)
 Скільки електронів необхідно для завершення зовнішнього рівня атома Na та Cl? Що необхідно зробити, щоб завершити зовнішній енергетичний рівень у цих атомів?
Скільки електронів необхідно для завершення зовнішнього рівня атома Na та Cl? Що необхідно зробити, щоб завершити зовнішній енергетичний рівень у цих атомів?
Отже, атом Натрію віддасть електрон, а атом Хлору – приєднає, перетворюючись на заряджені частинки – Йони. Учні самостійно роблять визначення, що таке Йони.
Йони – це електрично заряджені частинки речовини, які утворюються з атомів або груп атомів у результаті віддачі або приєднання до них електронів.
Б) Порівняйте будову атома та йона Магнію і результати запишіть у вигляді таблиці:
|
Ознаки |
Атом Мg
|
Йон Мg |
|
Заряд ядра |
|
|
|
Кількість електронних шарів та розподіл електронів |
|
|
|
Кількість електронів на останньому шарі |
|
|
|
Загальний заряд |
|
|
В) Враховуючи будову атомів металів та неметалів, зробіть висновок, йони якого виду будуть вони утворювати і чому.
2. Йонний зв'язок
Запишемо схему утворення сполуки NaCl. Будову атомів ми розглянули в попередньому підпункті. За рахунок чого буде виникати цей зв'язок? Сформулюйте визначення йонного зв’язку та порівняйте з визначенням у підручнику.
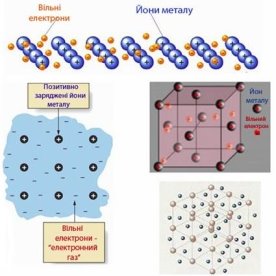
Хімічний зв'язок, утворений з допомогою електростатичної взаємодії йонів, називається йонним зв’язком.
3. Характеристика йонного зв’язку
А) не спрямований.
Б) ненасичений.
В) речовини з йонним зв’язком це тверді речовини з високою температурою плавлення.
V. Робота над гіпотезами, висловленими учнями
Вчитель. Використовуючи вивчений матеріал, порівнюємо ковалентний та йонний зв'язок. Результати самостійно записуємо у вигляді таблиці. (Завершивши роботу, учні порівнюють свою таблицю з таблицею, представленою вчителем).
|
Ковалентний зв'язок |
Йонний зв'язок |
|
Утворений за рахунок спільних електронних пар |
Утворений з допомогою електростатичного тяжіння між йонами |
|
Утворюється між атомами неметалів |
Утворюється здебільшого між атомами металів та неметалів |
|
Утворюється між елементами, які не відрізняються електронегативністю або відрізняються не більш ніж на 1,6 |
Утворюється між елементами, які значно відрізняються електронегативністю |
|
Зв'язок спрямований та насичений |
Зв'язок неспрямований та ненасичений |
|
Речовини знаходяться в газоподібному, рідкому або твердому станах з низькою температурою плавлення |
Речовини знаходяться в твердому стані з високою температурою плавлення |
VІ. Підсумки уроку. Оцінювання знань учнів Оцінюються учні, які працювали на етапі актуалізації опорних знань, а також окремі учні (за вибором вчителя), які заповнили таблицю.
VІІ. Домашнє завдання
- Вивчити § 14.
- Виконати завдання № 91, 93, 97*
- Вказати сполуки з йонним зв’язком: кисень, кухонна сіль, водень, алюміній хлорид, вуглекислий газ, алюміній оксид.
- *Написати казку, використовуючи вивчений матеріал.
Список використаних джерел :
1. Хімія.7 - 9 класи – Програма для загальноосвітніх навчальних закладів. Хімія. 7-9 класи (оновлена), затверджена наказом МОН України від 07.06.2017 № 804. (http://mon.gov.ua/activity/education/zagalna-serednya/navchalni-programi-5-9-klas-2017.html)
2. Критерії оцінювання навчальних досягнень учнів у системі загальної середньої освіти,— К.; Ірпінь, 2004,— 176 с.
3. Шарко В. Д. Сучасний урок: технологічний аспект: Посібник для вчителів і студентів,— К., 2005,— 220 с.
4. Хомченко Г. П. Пособие по химии для поступающих в вузы,— 4-е изд., испр. и доп,— М.: ООО «Издательство «Новая Волна»», 2002,-480 с.
5. Савчин М. М., Ковальчук Н. І. Хімія. Вимірник навчальних досягнень. Діагностично-тренувальні завдання. 9 клас,— Л.: ВНТЛ-Класика, 2004,— 336 с.


про публікацію авторської розробки
Додати розробку
