«Хімічні властивості лугів: дія на індикатори, взаємодія з кислотами, кислотними оксидами, солями. Заходи безпеки під час роботи з лугами»
Про матеріал
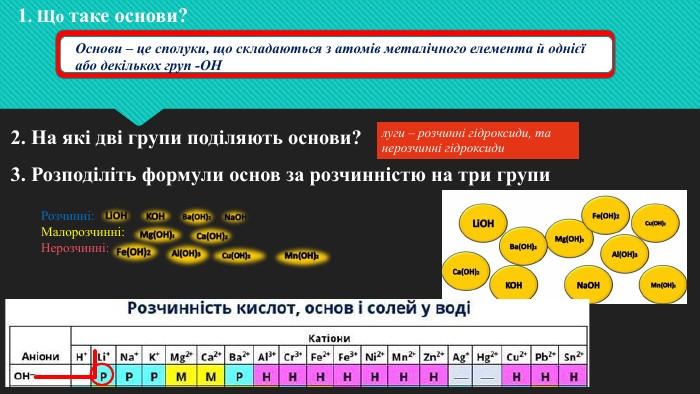
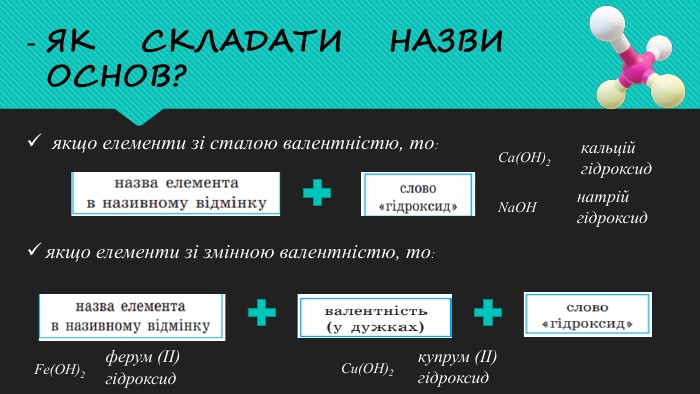
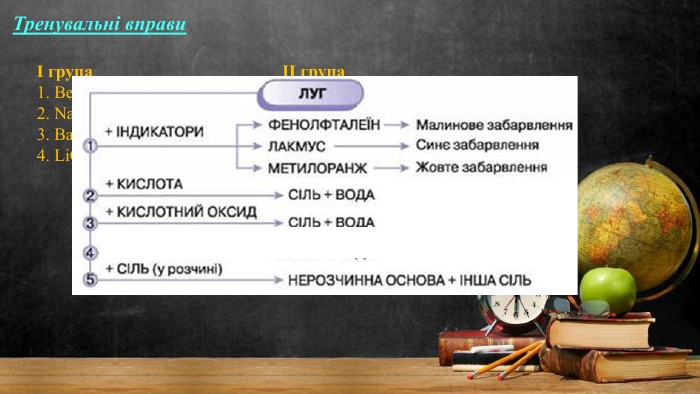
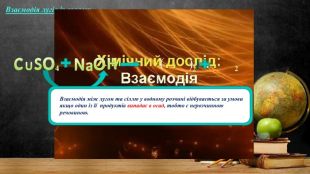
Мета: поглибити знання учнів про основні класи неорганічних сполук на прикладі лугів; закріпити знання про склад і назви основ, розглянути хімічні властивості лугів на прикладі взаємодії з кислотами, оксидами та солями; розвивати навички складати рівняння хімічних реакцій; виховувати самостійність та уважність. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку