Хімічні властивості насичених одноосновних карбонових кислот. Реакція естерифікації. Застосування і одержання етанової кислоти.











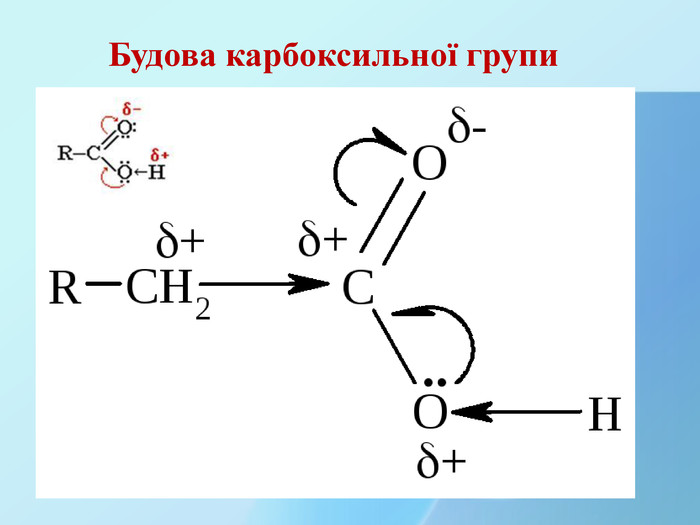















Перевірка виконання домашнього завдання (взаємопереревірка)Впр. 130 ст 113 (4 бали )Назви кислот 4 3 2 1 4 3 2 1 А) СН3 – СН2 – СН2 – СООН Б) СН3 – СН – СН – СООН СН3 С2 Н5 СН3 2- метилбутанова кислота 3-етил-2-метилбутанова кислота 3 2 1 В) СН2 – СН2 – СООН Вr3-бромопропанова кислота
Перевірка виконання домашнього завдання (взаємопереревірка)Впр. 133 ст 114 (6 балів – 1,5 бали за кожну правильну формулу)Зобразіть структурні формули молекул кислот С6 Н12 О2, якщо головні ланцюги в них містять чотири атоми Карбону. Назвіть сполуки. СН3 4 3 2 1 4 3 | 2 1 СН3 – СН – СН – СООН; СН3 – СН2 –СН – СООН; СН3 СН3 СН3 2, 3- диметилбутанова кислота 2,2 –диметилбутанова кислота 4 3 2 1 4 3 2 1 СН3 – СН2 – СН2 – СООН СН3 – СН2 – СН2 – СООН С2 Н5 С2 Н5 3-етилбутанова кислота 2-етилбутанова кислота. Максимальна кількість балів – 10 балів за усі виконані завдання
Дослідити хімічні властивості насичених одноосновних карбонових кислот. Навчитися виявляти органічні кислоти у продуктах харчування. Порівняти хімічні властивості мінеральних та органічних карбонових кислот: знайти спільні властивості та специфічні, характерні тільки для карбонових кислот. Пояснити, якою функціональною групою визначаються специфічні хімічні властивості карбонових кислот. Розглянути способи добування етанової кислоти. Розширити свої знання про сфери застосування оцтової кислоти. Отримати інформацію, яку використаємо у повсякденному житті. Завдання уроку
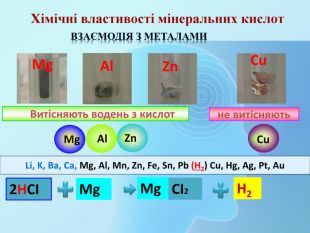
Які сполуки називаються мінеральні кислоти?Наведіть приклади відомих вам кислот, які ми використовуємо у побуті. За допомогою яких сполук можна виявити мінеральні кислоти?Які частинки, що входять до складу мінеральних кислот, змінюють забарвлення індикатора?Які хімічні властивості характерні для мінеральних кислот?Які сполуки називаються одноосновні насичені карбонові кислоти?Що таке функціональна група? На що вона впливає?Яка функціональна група міститься у карбонових кислотах?Пригадайте
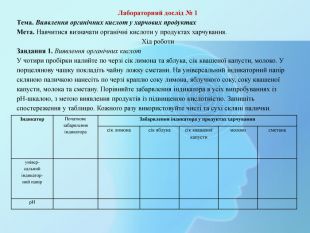
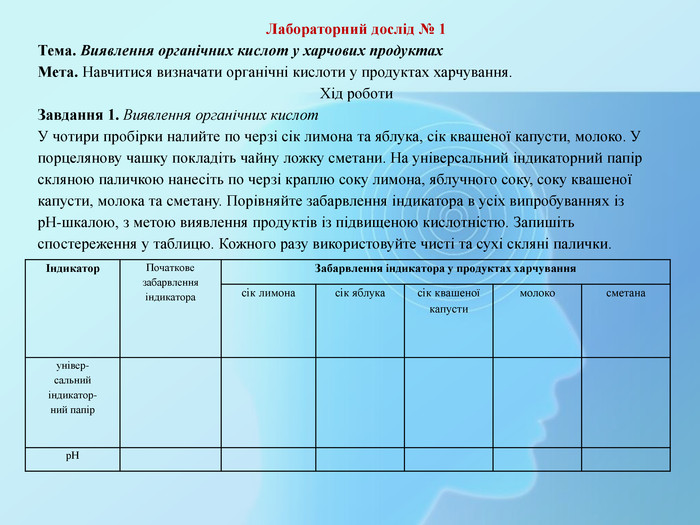
Лабораторний дослід № 1 Тема. Виявлення органічних кислот у харчових продуктах. Мета. Навчитися визначати органічні кислоти у продуктах харчування. Хід роботи. Завдання 1. Виявлення органічних кислот. У чотири пробірки налийте по черзі сік лимона та яблука, сік квашеної капусти, молоко. У порцелянову чашку покладіть чайну ложку сметани. На універсальний індикаторний папір скляною паличкою нанесіть по черзі краплю соку лимона, яблучного соку, соку квашеної капусти, молока та сметану. Порівняйте забарвлення індикатора в усіх випробуваннях із р. Н-шкалою, з метою виявлення продуктів із підвищеною кислотністю. Запишіть спостереження у таблицю. Кожного разу використовуйте чисті та сухі скляні палички. Індикатор. Початкове забарвлення індикатора. Забарвлення індикатора у продуктах харчуваннясік лимонасік яблукасік квашеної капустимолоко сметанаунівер-сальнийіндикатор-ний папір р. Н
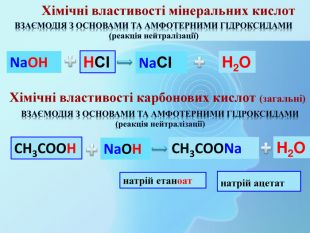
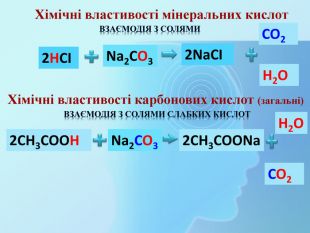
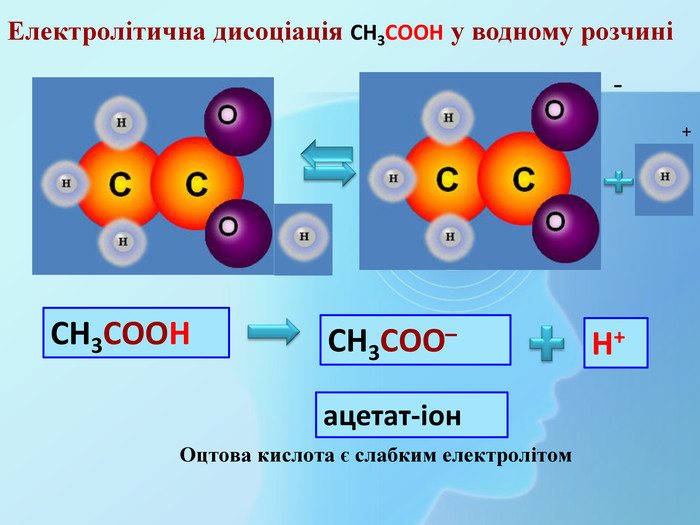
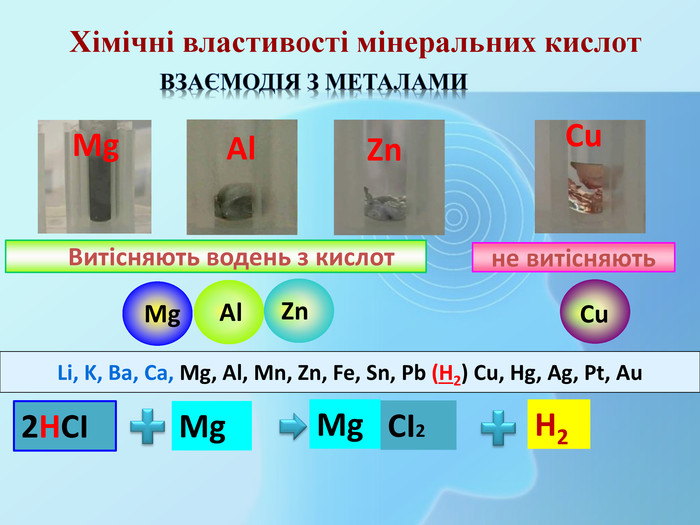
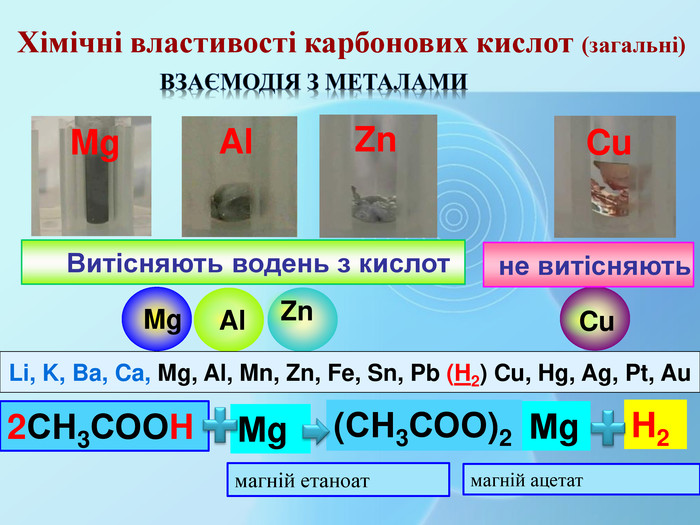
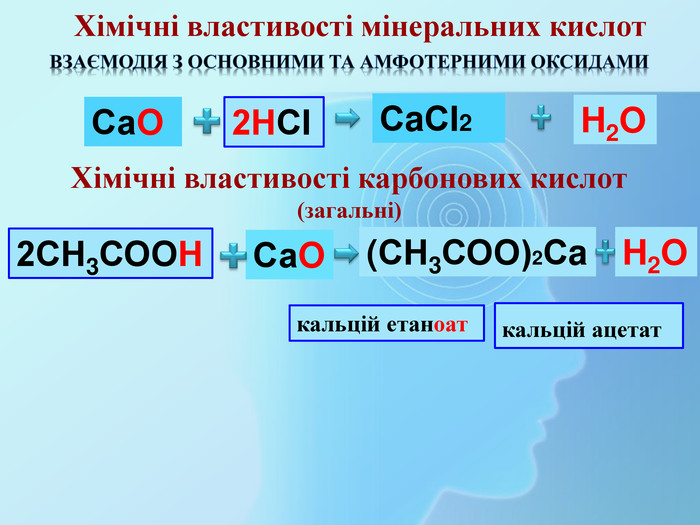
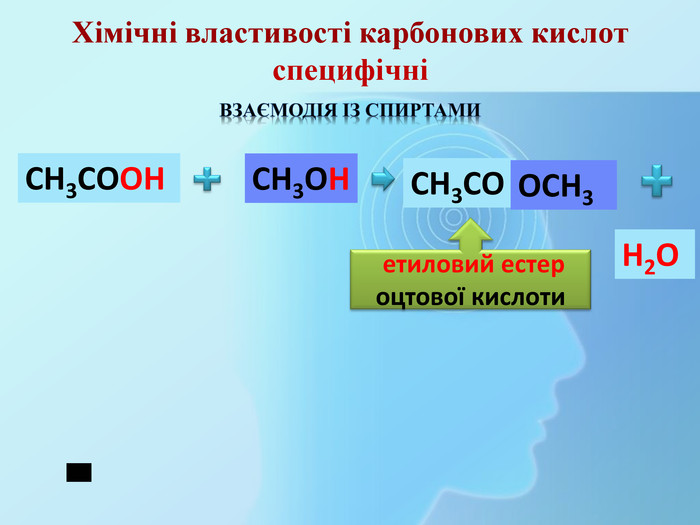
СН3 СООН Na. OHСН3 СООNa Взаємодія з основами та амфотерними гідроксидами (реакція нейтралізації)Хімічні властивості карбонових кислот (загальні) H2 Oнатрій етаноатнатрій ацетат Хімічні властивості мінеральних кислот. Na. OHНСІ Na. СІ H2 OВзаємодія з основами та амфотерними гідроксидами (реакція нейтралізації)
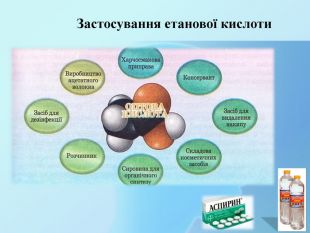
{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}Галузь промисловостіЗастосування. Хімічна промисловість. Харчова промисловість Побут. Медицина. Косметологія. Виробництво ацетатного волокна;барвників, засобів боротьби з комахами та рослинами; розчинників та екстрагентів;фруктових есенцій, органічного скла,ировина для виготовлення полімерів. Харчосмакова приправа;консервант; застосування фруктових есенцій. Засіб для дезинфекції,видалення накипу; помічник на кухні. Виробництво ацетилсаліцилової кислотидля лікування та зниження температури тіла. Складова косметичних засобів; виготовлення віддушок.
Інтерактивна справа «Слідство ведуть хіміки»Під час введення за допомогою комп’ютера результатів лабораторних досліджень загубилися деякі формули речовин. Допоможіть визначити можливі варіанти, якщо частина інформації збереглася. А) С3 Н7 СООН + …→ (С3 Н7 СОО)2 Zn + …Б) … + Ва(ОН)2 → (С2 Н5 СОО)2 Ва + …В) НСООН + Са. СО3→ …+ …+…. Г) ……… + …→СН3 СООС4 Н9 + …
Розв'яжуть задачу. Кафедра неорганічної хіміїЯка б маса оцтової кислоти витратилась на розчинення перлини, масою 10 г. Перлина за своєю хімічною будовою є кальцій карбонат.органічної хіміїКафедра органічної хіміїЯка б маса оцтової кислоти витратилась на розчинення перлини, масою 5 г. Перлина за своєю хімічною будовою є кальцій карбонат.органічної хіміїКафедра прикладної хіміїЯка б маса оцтової кислоти витратилась на розчинення перлини, масою 15 г. Перлина за своєю хімічною будовою є кальцій карбонат. Кафедра хімічного синтезу. Яка б маса оцтової кислоти витратилась на розчинення перлини, масою 20 г. Перлина за своєю хімічною будовою є кальцій карбонат.
Домашнє завдання1. Написати рівняння реакцій у йонно-молекулярній формі для оцтової кислоти (можна скористатись підручником Савчин М. М. § 17 ст. 83-85. за посиланням: ttps://lib.imzo.gov.ua/xmlui/handle/123456789/964 Підручник Попель П. П. Крикля Л. С. Хімія 10 клас §19 ст 116-119, впр. 140, 143 а. Творче завдання. Підберіть матеріал і підготуйте проект на тему:«Рецепти консервування овочів, де використовується оцет». (каф. хімічного синтезу)«Музеї оцту у світі». (каф. неорганічної хімії)«Етери та естери у косметиці». (каф. органічної хімії)«Застосування естерів в харчовій і парфумерній галузях промисловості». (каф. прикладної хімії)


про публікацію авторської розробки
Додати розробку