Хімічні властивості основ
Розробка уроку з хімії у 8 класі
вчителя-методиста Біловодського ліцею «Лідер»
Філоненко Жанни Дмитрівни
Тема уроку: Хімічні властивості основ
Цілі уроку: Закріпити знання учнів про класифікацію основ, їх фізичні властивості, розширити знання про хімічні властивості класів неорганічних сполук на прикладі основ, дослідити дію лугів на індикатори та їх відношення до оксидів, кислот, солей, удосконалювати навички роботи з реактивами, вміння складати рівняння, розвивати креативне мислення, формувати комунікативні вміння.
Тип уроку: Формування умінь та навичок, урок-дослідження.
Форми роботи: Демонстраційний експеримент, лабораторні досліди, робота з опорною схемою, робота в групах.
Хід уроку
І Актуалізація опорних знань, мотивація навчальної діяльності.
Ми вивчаємо велику та важливу тему – «Основні класи неорганічних сполук». Чи добре ми їх розрізняємо?
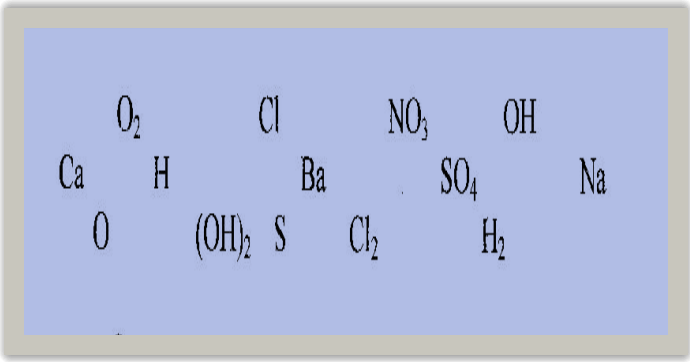 Я знайшла записи алхіміків, які намагалися згрупувати записані символи, але їм не вистачило для цього знань. (Слайд№2)
Я знайшла записи алхіміків, які намагалися згрупувати записані символи, але їм не вистачило для цього знань. (Слайд№2)
Декарт говорив: «Щоб удосконалити свій розум, треба більше думати, ніж заучувати». (Слайд№3)
Давайте витягнемо зі схованки наших знань щось цінне: ту інформацію, яка потрібна для засвоєння нової теми.
Вправа «Запис алхіміків» ( Робота в групах ).
Спробуймо записати формули речовин і розподілити їх за класами. (Слайд№2)
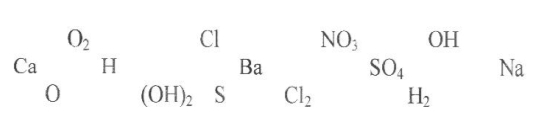
Відповідь.
|
Оксиди |
Основи |
Кислоти |
Солі |
|
|
|
|
|
За яким принципом ви розподілили речовини в групи?
(за загальними ознаками).
Загальні ознаки
- оксидів: складаються із двох елементів, один з яких Оксиген;
- основ: складаються з атомів металевого елемента та групи ОН;
-кислот: містять атом Гідрогену, який стоїть у формулі першому місці;
- солей: складаються з атомів металу та кислотного залишку.
Інтерактивна вправа «Мікрофон»
- Який клас неорганічних сполук називається основами?
- Чим визначається кількість гідроксильних груп в основі?
- Чому NaOH , але Ca ( OH ) 2 ?
- Дайте назви основам: Fe ( OH ) 2 , CuOH .
- На які групи діляться основи?
- Як називаються розчинні у воді основи?
- За допомогою таблиці розчинності наведіть приклади розчинних у воді основ. Дайте їм назви. ( 5-6 учнів по ланцюжку записують їх формули на дошці ).
Текстовий диктант
Вставити ключові слова.
Гідроксиди металічних елементів, або …….. – складні речовини, які містять у своєму складі атоми ……………… та …………………. Кількість гідроксогруп дорівнює …………….. . Назва основ утворюється від назви ……………………….. і слова ……………………… . Якщо елемент має змінну валентність, її вказують …………….. . Усі основи діляться на …………………… і …………………… . Розчинні у воді основи називаються ……………………..
Формульний диктант. (Слайд№4)
- Запишіть формули гідроксидів таких елементів:


- Дайте їм назву.
- Підкресліть формули лугів.
Що являють собою луги? (Слайд№5)
Це тверді речовини; їдкий натр і їдке калі, мильні навпомацки. Вони роз'їдають шкіру рук, тканини, папір.
(Техніка безпеки: змити водою, допоки не зникне відчуття милкості. А потім нейтралізувати розчином борної кислоти. (Слайд№6)
Чи достатньо нам знань про цей клас речовин? Чи можемо ми судити про те, чим вони можуть бути корисні людині? Чому натрій гідроксид застосовують у виробництві мила, а кальцій гідроксид – у будівництві?
Сьогодні ми маємо познайомитися з основами більш детально.
Тема уроку: Хімічні властивості основ. (Слайд№7)
ІІ. Поглиблення знань, вивчення нового матеріалу.
Як розпізнати луги?
Телеграма з митниці. (Слайд№8)
Реакції основних оксидів з водою. Лакмус дозволяє виявити основи.
Лабораторний дослід №2, с.70 підручника. Робота у групах.
Обговорення порядку роботи. Техніка безпеки.
Яку кількість лугу та індикатора слід брати?
Таблиця "Зміна забарвлення індикатора в розчинах лугів і кислот" (Слайд№9)
Висновки за наслідками дослідження.
Чи можемо ми припустити, із чим реагують луги?
Звернемося до таблиці «Взаємозв'язок між класами неорганічних сполук» і, виходячи з цієї таблиці, спробуємо спрогнозувати властивості основ. (Слайд№10)
|
|
Основні оксиди |
Кислоти |
Основи |
Солі |
|
Кислотні оксиди |
+ |
|
+ |
|
|
Кислоти |
+ |
|
+ |
+ |
|
Основи |
|
+ |
|
? |
|
Солі |
|
+ |
? |
|
Основи реагують з кислотами та кислотними оксидами.
Завдання:
Дослідити властивості лугів.
Лабораторний дослід №3 с.71 підручника.
Взаємодія лугу з хлоридною кислотою ( І група) та сульфатною кислотою ( ІІ група) до зникнення забарвлення фенолфталеїну.
До якого типу належать ці реакції? (Слайд№11)
Демонстрація досліду взаємодії лугу із кислотним оксидом.
Чи відбувається реакція?
Яку ознаку протікання хімічної реакції ми спостерігаємо?
Записуємо рівняння, визначаємо тип реакції. (Слайд№12)
Наші прогнози підтвердились?
Яку реакцію, характерну для основ, ми можемо ще припустити виходячи з цієї таблиці? (Слайд№10)
- Взаємодія із солями.(Слайд№13)
Робота у групах.
![]() 1-а група CuSO 4 + NaOH
1-а група CuSO 4 + NaOH
![]() 2-а група Al 2 ( SO 4 ) 3 + NaOH
2-а група Al 2 ( SO 4 ) 3 + NaOH
![]() 3-я група K 2 CO 3 + NaOH
3-я група K 2 CO 3 + NaOH
Чи відбувається реакція?
- Усі наші припущення підтвердилися.
Вносимо доповнення до таблиці «Взаємозв'язок основних класів неорганічних речовин». (Слайд№14)
Складаємо опорну схему за хімічними властивостями основ. (Слайд№15)
1+кислота
2+кислотний оксид (тільки з лугами)
3+сіль (тільки у водних розчинах)
ІІІ Закріплення вивченого матеріалу( Завдання на слайді№16 )
1.Запишіть формули гідроксидів, що відповідають оксидам складу:
І варіант : CuO, Li2O
ІІ варіант :Rb2O,ZnO
2.З якими речовин реагує:
І варіант КОН: Ba( OH) 2 , CuSO 4 , Na 2 O, CO 2 , HCl .
ІІ варіант NaOH: CaO , Mg( OH) 2 , PbSO 4 , H 2 SO 4 , SO 2 .
3.Здійснити перетворення:
І варіант: Mg → MgO → Mg(NO 3 ) 2 → Mg(OH) 2
ІІ варіант: Ba → BaO → Ba(OH) 2 → Ba(NO 3 ) 2
Домашнє завдання : параграф11, вправа №102 с.75


про публікацію авторської розробки
Додати розробку
