Інтегрований урок (хімія - фізика): «Подорож до царства Рудого біса»
Мета: сформувати уявлення про корозію з точки зору окисно-відновних процесів; показати значення корозії для народного господарства; ознайомити учнів з типами корозії, механізмом їх дії, зі способами захисту металів від корозії; продовжити формувати вміння встановлювати причини-наслідкові зв'язки між будовою та властивостями металів.
Урок в 10 класі «Подорож до царства Рудого біса».(Слайд 1)
Мета: (Слайд 2)сформувати уявлення про корозію з точки зору окисно-відновних процесів; показати значення корозії для народного господарства; ознайомити учнів з типами корозії, механізмом їх дії, зі способами захисту металів від корозії; продовжити формувати вміння встановлювати причини-наслідкові зв’язки між будовою та властивостями металів.
Обладнання: комп’ютер, мультимедійна дошка; залізні цвяхи, занурені в різні розчини.
Хід уроку
Епіграф: Знати – значить перемогти!
А.Н.Несміянов
І. Актуалізація та мотивація
Учитель хімії: Діти! Сьогодні у нас не зовсім звичайний урок. (Слайд 3)Перед нами важка задача: подорож до царства «рудого біса». «Рудий біс» - це давній та небезпечний ворог більшості металів, які застосовують в побуті і техніці. Небезпека цього ворога в тім, що невидимий, він залишається завжди цілим та неушкодженим, а метали та сплави мають великі втрати. Ну як, здогадалися, що це за ворог?
Учень: Це корозія.
Учитель хімії: Вірно. Отже, ми знаємо, хто заховався під іменем Рудий біс. Щоб перемогти ворога ми повинні відкрити усі його таємницю. Невипадково епіграфом до нашого уроку взято вислів академіка Несміянова. Ми повинні усе дізнатися про корозію, щоб навчитися з нею боротися.
Чути скрипіння та скреготіння. З'являється Рудий біс.
Рудий біс: Як? Що я чую? Хтось зібрався зі мною боротися? І навіть збирається отримати перемогу? Та чи відомо вам, що, за підрахунками економістів, збитки, нанесені мною, в багато разів перевищують втрати від такого страшного стихійного лиха, як пожежа? І це не дивно: полум’я вирує порівняно рідко та короткочасно, а я дію постійно, ні на мить не припиняю свою підривну діяльність. Я тримаю в острасі метали та сплави усього світу. Близько 15% вироблених у світі металів (це 20 млн тон) кожного року стають моїми жертвами. Я їх знищую! Суттєві збитки я спричиняю й не на пряму. Пригадайте витік нафти або газу із трубопроводу, який я «з'їв». Я достроково виводжу із ладу деталі, обладнання і навіть цілі споруди. А ви сперечатися зі мною вирішили? Та чи вистачить у вас знань? Потрапити до мого царства може тільки той, хто правильно накресле ключ-пропуск.
Учитель хімії: Друзі, ключ – це наші знання. Спробуємо впоратися з цим завданням. Виконуємо графічний диктант по варіантам.
Завдання: (Слайд 4,5) відмітити знаком «۸» на відрізку номер положення, яке вважаєте невірним, з яким ви не згодні. Усі положення диктанту розглянути по відношенню до: І варіант – міді; ІІ варіант – калію.
1. Це активний лужний метал.
2. Цей метал займає друге місце за електропровідністю.
3. Це самий м'який метал.
4. Цей метал входить до складу сплаву бронзи.
5. На зовнішньому електронному рівні атома цього металу два електрони.
6. Метал не взаємодіє з водою.
7. Цей метал може витіснити цинк із розчину його солі.
8. В реакціях з галогенами виступає окисником.
9. Цей метал можна отримати шляхом електролізу розплаву її солі.
10. При зберіганні на сухому повітрі метал окислюється.
Перевірка ключа (Слайд 6)
Рудий біс: (збирає ключі-пропуски). Вимушений буду пропустити вас до мого царства. Бачу, що ви підготувалися до подорожі.
ІІ. Вивчення нового матеріалу
Учитель хімії: Щасливої дороги! Зошит перетворюється в ваш дорожній щоденник, де ви будете занотовувати найважливіше із того, що з'ясуємо за час нашої подорожі. Але де подівся Рудий біс? Куди він зник? Я забула, що це невидимий ворог, тобто, може зникати та з'являтися зовсім несподівано, треба бути готовими. (Слайд 7)
Ты слышишь ровный шум колёс?
И вот перед перроном
Остановился паровоз
С прицепным вагоном.
Ми на зупинці «Інформаційній» (Слайд 8)
Зупинка «Інформаційна»
Учитель хімії: «Ржа ест железо» - говорить російська народна мудрість. Іржа на поверхні стальних та чавунних виробів – це яскравий приклад корозії. Іржавінням називають тільки корозію заліза та його сплавів. Інші метали кородують, але не іржавіють. Що ж таке корозія?
Корозія – це руйнування металу під дією навколишнього середовища; це окисно-відновний процес, в наслідок якого атоми металів перетворюються на йони. (Слайд 9) Корозію можна класифікувати за
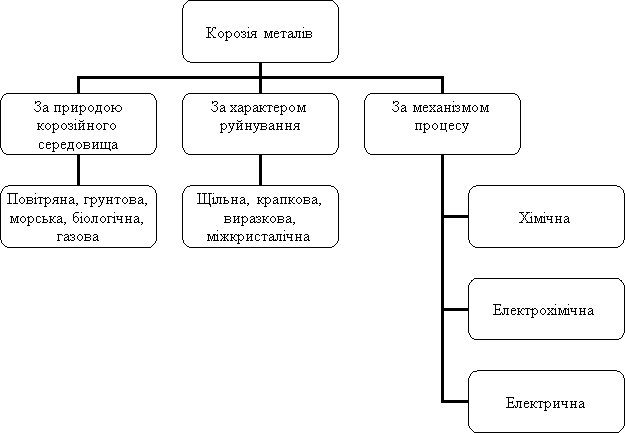
Хімічна корозія (Слайд 10) – це руйнування металу внаслідок окиснення в навколишньому середовищі без виникнення електричного струму в системі.
Окиснення заліза відбувається під дією кисню повітря або кисню, розчиненого у воді.
3Fe + 2O2 = Fe3O4 (FeO•Fe2O3),
4Al + 3O2 = 2Al2O3.
Для поверхні алюмінію цей процес позитивний, тому що оксидна плівка щільно прилягає до поверхні металу та припиняє подальший доступ кисню до поверхні металу.Оксидна плівка заліза дуже рихла та не прилягає щільно до поверхні металу, тому кисень проникає все далі й далі, корозія відбувається до повного руйнування предмету. (Слайд 11)
Учитель фізики: Електрохімічна корозія (Слайд 12) – це руйнування металу внаслідок виникнення гальванічної пари та появи всередині системи електричного струму. Електрохімічна корозія виникає при контакті двох металів (гальванічної пари) через електроліт, електродами при цьому є самі метали. При виникненні гальванічної пари з’являється електричний струм тим більшої сили, чим далі знаходяться один від одного метали в електрохімічному ряді напруг металів. При цьому потік електронів рухається від більш активного металу до менш активного; більш активний метал в цьому випадку руйнується (кородує). (схема) Для виникнення електрохімічної корозії потрібна наявність кисню та води. Розглянемо випадок, коли контакту металів немає, причому метал (залізо) знаходиться на повітрі. (Слайд 13,а) Деякі ділянки поверхні заліза є анодом, на якому відбувається його окиснення (Ео – стандартний електродний потенціал):
Fе(тв.) = Fе2+(водн.) + 2е-, Еоокисл = +0,44 В
Електрони, які при цьому утворюються переміщаються по металу до інших ділянок поверхні, які відіграють роль катоду. На них відбувається процес відновлення кисню:
О2 (г.) + 4Н+(водн.) + 4е- = 2Н2О(р.)
Еовідн = +1,23 В (рис.1)
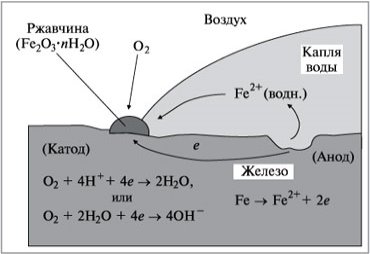
Учитель хімії: У відновленні кисню приймають участь йони Н+ . якщо концентрація Н+ знижується, відновлення кисню ускладнюється. Визначено, що залізо, що знаходиться в контакті з розчином, рН якого вище 9-10 (середовище лужне), не кородує. (Слайд 13,б)
В процесі корозії йони Fе2+ , що утворюються на аноді, окисляються до Fе3+:
4 Fе2+(водн) + О2(г.) + (2n + 4)Н2О(р.) = 2 Fе2О3· nН2О(тв.) + 8Н+(водн.)
Оскільки роль катоду відіграє та частина поверхні, яка краще забезпече6на притоком кисню, іржа частіше за все з’являється саме на цих ділянках. Якщо ви уважно оглянете лопату, що перебувала деякий час на відкритому повітрі з брудом на лезі, то відмітите, що під брудом на поверхні металу утворилися заглиблення, а іржа з’явилася скрізь, куди міг потрапити кисень.
Учитель фізики: (Слайд 14) з підсиленням корозії в присутності солей стикаються автомобілісти в тих місцевостях, де взимку для боротьби з ожеледицею шляхи посипають сіллю. Вплив солі обумовлений тим, що утворені йони створюють електроліт, необхідний для виникнення замкнутого електричного ланцюга. Наявність анодної та катодної ділянок на поверхні заліза призводить до утворення на ній двох неоднакових хімічних оточень. Вони можуть виникнути внаслідок наявності домішок або дефектів в кристалічній граткі. В місцях, де є домішки або дефекти, мікроскопічне оточення конкретного атома Феруму може викликати деяке збільшення або зменшення його ступеня окиснення в порівнянні з «нормальними» атомами в кристалічній граткі. Тому такі місця здатні відігравати роль анодів або катодів. Надчисте залізо, в якому кількість подібних дефектів зведено до мінімуму, набагато менше кородує в порівнянні зі звичайним залізом.
Учень: Класичний приклад – відома Кутубська колона (Слайд 15) в Індії поблизу Делі, яка майже півтори тисячі років стоїть і не руйнується, незважаючи на жаркий та вологий клімат. Виготовлена вона із заліза, в якому майже нема домішок. Яким чином давні металурги отримали такий чистий метал, до нині залишається загадкою.
Учень: На початку минулого сторіччя на замовлення одного американського міліонера була побудована розкішна яхта «Зов моря». Дно її було обшито монель-металом (сплав міді та нікеля), а раму керма, киль та інші деталі виготовлено зі сталі. Коли яхту спустили на воду, виник гігантський гальванічний елемент, що складався із катоду (монель-металу), стального аноду і розчину електроліту – морської води. Наслідки були жахливі! Ще до виходу у відкрите море яхта повністю вийшла з ладу, так що «Зов моря» залишився в історії мореплавства як приклад конструкторської недалекозорості та самовпевненості.
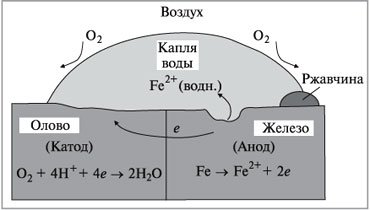
Учитель хімії: Спробуємо розібратися, що відбулося? (Слайд 16) Розглянемо контакт двох металів на прикладі олова та заліза. Залізо часто покривають іншим металом, наприклад, оловом, цинком або хромом, щоб захистити від корозії. Олово захищає залізо доти, поки захисний шар залишається неушкодженим. Варто його ушкодити, як залізо починає взаємодіяти з повітрям та вологою, а олово навіть прискорює процес корозії, тому що відіграє роль катоду в електрохімічному процесі. Порівняння окисних електродних потенціалів заліза та олова свідчить, що залізо окислюється швидше за олово:
Fе(тв.) = Fе2+ (водн.) + 2е-, Ео = +0,44 В,
Sn(тв.) = Sn2+(водн.) + 2е-, Ео = +0,14 В,
Тому залізо в даному випадку є анодом та окислюється (рис.2).
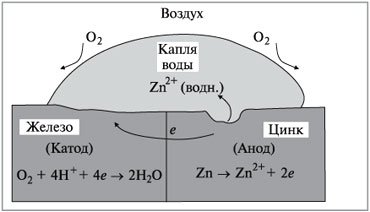
Оцинковане залізо отримують, (Слайд 17) шляхом покривання його тонким шаром цинку. Цинк захищає залізо від корозії навіть після ушкодження цілісності покриття. У цьому випадку залізо в процесі корозії відіграє роль катоду, тому що цинк окислюється легше, ніж залізо (рис.3):
Zn(тв.) = Zn2+ (водн.) +2е- , Ео = +0,76 В.
Відповідно, цинк є анодом і кородує замість заліза.
Учитель хімії: При використанні металічних матеріалів важливе питання про швидкість корозії, від чого вона залежить? І ми прибуваємо на зупинку «Експериментальна» (Слайд 18)
Зупинка «Експериментальна»
Демонстрація результатів досліду.
Питання: (Слайд 19)
- В яких склянках залізний цвях про кородував більше, в яких менше, а в яких корозія не відбулася?
- Визначити тип корозії у кожній склянці.
- Пояснити, що підсилює корозію, а що сповільнює?
- По досліду сформулюйте загальний висновок.
Зупинка «Практична» (Слайд 20)
Учитель хімії: Великий Гете сказав: «Просто знать – ещё не всё, знания нужно уметь использовать». Ми з вами на зупинці, де всі перетворюються на практиків. Використовуючи знання, отримані під час подорожі, давайте визначимо яке значення корозії для людини та як з нею боротися.
Учень: Корозія металів дає велику економічну шкоду. (Слайд 21) Корозія призводить до зменшення надійності роботи обладнання: апаратів високого тиску, парових котлів, металічних контейнерів для токсичних та радіоактивних речовин; до забруднення продукції, тобто до зниження її якості. Іноді зубні коронки, виготовлені із різних металів (золота й сталі) і близько розташовані одна біля одної, надають своєму господарю неприємних болючих відчуттів. Оскільки слина є електролітом, ці коронки утворюють гальванічний елемент. Електричний струм протікає по десні та викликає зубний біль.
Щоб запобігти глобальним катастрофам на суднах, фабриках і заводах, необхідно вивчати методи захисту від цієї проблеми. Водночас необхідно знайти застосування корозії металів. Одним із напрямків може бути її застосування для руйнування конструкцій у важкодоступних місцях. Вивчаючи корозію більш детально, ми бачимо, має як позитивний, так і негативний вплив. Руйнування металів і сплавів можна застосовувати як один із способів боротьби із космічним сміттям. Якби залізо, подібно до срібла та золота, не іржавіло, то ми б не існували, і жодна рослина не зеленіла б на Землі. Розчинена у воді іржа складає частину їжі рослин і надає їм зеленого кольору. Та ж іржа постачає Ферум до нашої крові і надає їй червоного забарвлення.
Учитель хімії: Які є основні способи боротьби з корозією? (Слайд 22)
Учитель фізики:
- (Слайд 23) Метал, який захищають відіграє роль катоду. Такий спосіб захисту називають катодним (так званий протекторний захист). Той метал, який буде руйнуватися в парі називають протектором. Наприклад, оцинковане залізо (залізо – катод, цинк – анод).
- (Слайд 24) Електрозахист. Конструкція, що знаходиться в середовищі електроліту, сполучається з іншим металом (зазвичай шматок заліза, рейки та ін.), але через зовнішнє джерело струму. Конструкцію приєднують до катоду, а метал – до аноду джерела струму (анод руйнується, а на катоді відбувається відновлення окисника).
Учитель хімії:
- (Слайд 25) Якщо метал, наприклад хром, утворює щільну оксидну плівку, його додають до заліза і утворюється сплав – нержавіюча сталь. Такі сталі називають легованими.
- Метал можна пасивувати – обробити його поверхню так, щоб утворилася тонка та щільна оксидна плівка, яка запобігає руйнуванню основної речовини. Наприклад, концентровану сульфатну кислоту можна перевозити в стальних цистернах, бо вона утворює на поверхні металу тонку, але дуже міцну плівку.
- (Слайд 26) Інгібітори (сповільнювачі) корозії також переводять метал в пасивний стан (гексаметилтетрамін (СН2)6N4). Останні роки розроблені летючі (атмосферні) інгібітори. Ними пропитують папір та обгортають металеві вироби.
- (Слайд 27) Захистити метал можна нанесенням на метал шару лаку або фарби. (На фарбування Ейфелевої башти вже витратили кошт більше, ніж на її створення.)
Учитель хімії: Ми багато дізналися про Рудого біса. Виявляється не такий вже він і непереможний. Тепер за допомогою наших знань ми можемо його перемогти.
Рудий біс (плаксивим голосом): Звичайно, усі на одного, усі проти мене, і нестерпний – я, і страшний – я, і підступний – я. чи в мені немає нічого доброго? Ні краплі? Ех, пропаща я душа! Ось зараз як розплачуся! А волога, та ще й солона, підсилює корозію…
Учитель хімії: Чого ти? Припини. Зовсім не потрібні нам іржаві сльози. Загостювалися ми у тебе. Час додому повертатися.
Рудий біс (обурено): (Слайд 28) Як це? – Повертатися? (показує на червоне світло світлофора) А це що? Хіба не бачите: у вас на шляху червоне світло – проходу немає!
Коль хотите домой возвратиться,
То придётся вам всем потрудиться.
Если сделана будет работа,
Я открою из царства ворота!
Учитель хімії: Рудий біс не випускає нас. Але я думаю, ви легко впораєтесь із завданням.
- Необхідно закріпити залізні деталі. Якими заклепками слід користуватися мідними чи цинковими, щоб сповільнити корозію заліза? Чому?
- Ось історія, що трапилася з норвезьким вантажним судном «Анатина». Трюми судна, яке тримало курс до Японії, були наповнені мідним концентратом. Корпус судна був стальним. Раптом судно протекло. Поясніть, що відбулося?
- Як називаються речовини, що сповільнюють корозію?
- Додавання яких елементів до сталі підвищує її корозійну стійкість?
- До стального дна машини, був запропонований протекторний захист. Який метал для цього захисту застосувати найкраще: цинк, мідь чи нікель?
- Чому більшість деталей швидше кородують поблизу підприємств?
- Лист заліза, покритий цинком, та лист заліза, покритий оловом, подряпали до заліза. Чи буде відбуватися корозія заліза в обох випадках?
- Як буде відбуватися процес корозії у тому випадку, якщо залізну водозливну трубу прибити до будинку алюмінієвими цвяхами?
- Який із компонентів забрудненого міського повітря є найбільш корозійноактивним по відношенню до металів, особливо при підвищеній вологості: N2, CO, SO2. Доведіть рівняннями реакцій.
Учитель хімії: Ми завершили нашу подорож до царства Рудого біса. Я сподіваюся, що вона вам запам’ятається і знання, отримані вами на уроці ви застосуєте в житті.
Рудий біс: Я відчиню вам залізну браму з мого царства. (Слайд 29) Шлях додому вільний.
ІІІ. Рефлексія. Підведення підсумків.
ІV. Домашнє завдання.
- (Слайд 30) §
- Відома Кутубська колона в Індії не іржавіє, не дивлячись на вологий та жаркий клімат. Виготовлена вона із заліза, в якому майже не має домішок. Поясніть, чому в даному випадку вона не підлягає корозії?
- Чому цинк не використовують для виготовлення консервних банок для покриття ним заліза?
- Проведіть дослід по корозії залізних цвяхів в «Фанті» або «Колі» та в розчині соди. Через тиждень принесіть цвяхи до школи, щоб обговорити результати дослідів. (Слайд 31)
1


про публікацію авторської розробки
Додати розробку
