Кількість речовини. Моль - одиниця кількості речовини
8 клас. Урок №33. Дата ___________
Тема уроку: Кількість речовини. Моль – одиниця кількості речовини. Стала Авогадро.
|
Навчальна мета: |
сформувати поняття про кількість речовини та одиницю вимірювання кількості речовини – моль; з’ясувати значення сталої Авогадро; |
|
Розвиваюча мета: |
розвивати вміння розраховувати число атомів і молекул за відомою кількістю речовини й кількість речовини — за відомим числом атомів чи молекул; |
|
Виховна мета: |
виховувати взаємоповагу, доброзичливість; |
|
Тип уроку: |
засвоєння нових знань, умінь і навичок; |
|
Форми роботи: |
фронтальне опитування, бесіда, розв’язання вправ |
|
Обладнання: |
хімічний диктант, постановка проблемного питання, розповідь учителя з демонстрацією на комп’ютері, розв’язування задач, колективне складання таблиці, робота в парах |
|
Література: |
|
Хід уроку
1. Організаційна частина (1хв)
1.1. Перевірка наявності учнів;
1.2. Перевірка готовності учнів до уроку;
2. Актуалізація опорних знань (2хв)
2.1. Перевірка домашнього завдання.
2.2. Оголошення теми програми і уроку
2.3. Повторення пройденого матеріалу
Складіть формули сполук:
1) калій сульфіду ;
2) ферум (ІІІ) хлориду;
3) манган (IV) оксиду;
4) барій флуориду;
5) кальцій сульфіду;
6) алюміній оксиду.
7) карбон (ІІ) оксиду;
8) сульфур (VI) оксиду;
9) літій сульфіду;
10) нітроген (IV) оксиду;
11) карбон (IV) оксиду.
3. Мотивація навчальної діяльності (1хв)
Будь-яка фізична величина — це певна характеристика об'єктів або явищ, яка може бути виміряна. Наприклад, властивості інертності тіла відповідає величина, яку називають масою, властивості просторової протяжності відповідає величина, яку називають довжиною.
У хімії, крім використання таких величин, як «маса» й «об'єм», застосовують величину «кількість речовини».
4. Основна частина (40хв)
Кількість речовини — це фізична величина, обумовлена числом структурних елементів: атомів, молекул, йонів, електронів або груп атомів.
Кількість речовини позначається літерою n (або ν).
МОЛЬ - ОДИНИЦЯ ВИМІРЮВАННЯ КІЛЬКОСТІ РЕЧОВИНИ.
Будь-яка фізична величина має свою одиницю вимірювання: маса вимірюється в грамах, довжина — в метрах.
Як ви гадаєте, в чому можна вимірювати кількість речовини?
Кількість структурних елементів можна вимірювати в штуках. Тільки атоми чи молекули дуже незручно вимірювати в штуках, тому що побачити або вибрати одну молекулу надзвичайно важко. Навіть якщо використовувати кратні величини — кілоштуки (103) або гігаштуки (109), то й такі кількості дуже важко відміряти. Тому хіміки ввели дуже велику порцію для вимірювання кількості речовини — 6,02∙1023 штук. На честь відомого італійського вченого Амедео Авогадро ця величина називається «стала Авогадро» й позначається NА
NA =6,02∙1023 1/моль
Одиниця вимірювання кількості речовини — моль.
1 моль — це така кількість речовини, яка містить 6,02∙1023 ( ≈6∙1023) атомів або молекул.
Також використовуються кратні величини — кіломоль (кмоль, 103 моль), мілімоль (ммоль, 10-3 моль), мікромоль (мкмоль, 10-6 моль).
Число Авогадро — це дуже велике число. Наприклад, якби всю поверхню Землі (включаючи річки, озера, моря й океани) вистелити рівномірним шаром такої кількості однодоларових купюр, то утворився б шар висотою 2 метри. Проте молекули, які ми рахуємо за допомогою сталої Авогадро, є дуже маленькими часточками. Якщо ми візьмемо 6 • 1023 молекул води, то навіть не зможемо наповнити склянку.
Як ви гадаєте, якщо ми візьмемо один моль двох різних речовин, чи будуть це однакові кількості за зовнішнім виглядом?
(Ні. Об'єм (або маса), який буде займати 1 моль речовини, буде залежати від об’єму (або маси), який займає молекула цієї речовини. Оскільки в різних речовин різні молекули, то й об'єм, і маса 1 моль речовин будуть різні.)
Вчитель демонструє на комп‘ютері різні речовини кількістю в 1 моль.
Увага звертається на те, що маса й об’єм 1 моль різних речовин відрізняються.


З. РОЗРАХУНОК КІЛЬКОСТІ РЕЧОВИНИ
ЗА ВІДОМИМ ЧИСЛОМ АТОМІВ І МОЛЕКУЛ.
Розповідь учителя.
Для розрахунку кількості речовини використовується формула:
![]() , де N — кількість часточок (або атомів молекул).
, де N — кількість часточок (або атомів молекул).
Розв'язування задач.
Яка кількість речовини містить 10,5•1023 атомів заліза?
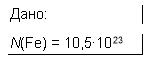
Розв'язання.
![]()
Відповідь: 1,75 моль заліза.
Робота в парах за завданнями:
- Скільки молекул міститься у воді кількістю речовини 15 моль?
- Скільки молекул міститься в сульфатній кислоті кількістю речовини 12 моль?
2. Дано:
а) 1,3∙1023 атомов Сульфуру;
б) 1,2∙1023 атомов Сульфуру.
Обчисліть кількість речовини.
3. Скільки атомів міститься в міді кількістю речовини 1,5 моль, 2,5 моль?
5. Підведення підсумків. Рефлексія. (2хв)
Учні разом з учителем перевіряють правильність оформлення опорного конспекту та правильність виконання практичних завдань, виправляють помилки. Рефлексія:
|
|
5.1. Повідомлення та обґрунтування оцінок
5.2. Домашнє завдання
5.3. Підготовка кабінету до наступного заняття.


про публікацію авторської розробки
Додати розробку
