Класифікація хімічних реакцій за кількістю і складом реагентів та продуктів реакцій.
Урок хімії у 9 класі
Вчитель: Кострюкова Ю.О.
Тема: Класифікація хімічних реакцій за кількістю і складом реагентів та продуктів реакцій.
Мета уроку: формування ключових компетентностей: комунікативна, уміння вчитись упродовж життя, соціальна, інформаційно-цифрова. Формування предметних компетентностей: актуалізувати уявлення учнів про різні типи хімічних реакцій, формувати навички учнів класифікувати хімічні перетворення; сприяти свідомій орієнтації учнів у типах хімічних реакцій; виховувати любов до предмету, соціальну культуру.
Тип уроку: урок засвоєння нових знань.
Технологія уроку: інформаційно-комунікативне навчання.
Хід уроку
І. Організація класу.
ІІ. Мотивація навчальної діяльності.
Хімічна реакція – це процес перетворення одних речовин на інші.
|
вихідні речовини (реагенти) → продукти реакції |
ІІІ. Актуалізація опорних знань.
Завдання 1

Завдання 2
Установіть відповідність між схемою і типом хімічної реакції:
|
Схема хімічної реакції: |
Тип хімічної реакції: |
|
а) обміну б) заміщення в) сполучення г) розкладу |
ІІІ. Вивчення нового матеріалу
- Реакція сполучення (с.94)– це реакція, унаслідок якої з кількох речовин утворюється одна:
Завдання 3.
Яка з поданих реакцій не належить до реакцій сполучення:
а) 2Mg+O2→2MgO;
б) 2CO+O2→2CO2;
в) CuO+H2→Cu+H2O;
г) СаО+СО2→СаСО3.
- Реакцією розкладу (с.94) називають реакцію, унаслідок якої з однієї речовини утворюється кілька речовин.
Завдання 4
Вкажіть ВСІ випадки реакції розкладу:
а) Са(ОН)2→ СаО+Н2О;
б) СOCl2→CO+Cl2;
в) Mg+2HCl→MgCl2+H2↑;
г) CH4→C+2H2↑.
До якого типу належить реакція в)?
- Реакція заміщення (с.94) — це реакція між складною і простою речовинами унаслідок якої атоми простої речовини заміщують атоми у складній речовині.
- Реакція обміну (с.95) – це взаємодія двох складних речовин, під час якої вони обмінюються структурними частинками.
Завдання 5
Вкажіть реакцію обміну:
а) NaOH+HCl→NaCl+H2O;
б) CaO+H2SO4→CaSO4+H2O;
в) Ca+H2SO4→CaSO4+H2↑;
г) Ba(OH)2+2HCl→BaCl2+2H2O.
Реакція обміну між основою та кислотою називається нейтралізація.
IV. Первинне засвоєння знань учнями. Складіть рівняяня відповідної реакції, вкажіть тип реакції:
- Знайомий з дитинства розчин наносять на ушкоджену ділянку шкіри для дезінфекції ран. При контакті розчину гідроген пероксиду з ушкодженою шкірою вивільняється активний кисень, який сприяє очищенню ранової поверхні.
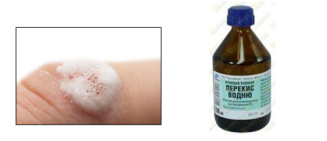
H2O2 = 2H2O + O2↑, (реакція розкладу)
2). Часто для гасіння вогню використовують воду. Вона перешкоджає доступу повітря й охолоджує предмет за рахунок випаровування. Але є речовини, які не можна гасити водою. До них належать лужні метали ( калій, натрій ), які активно взаємодіють з водою, що може тільки посилити пожежу.
2Na+2H2O→2NaOH+H2↑, (реакція заміщення)
Найефективніший спосіб гасіння полум’я, який використовується в хімічних лабораторіях, – це запобігання доступу повітря за допомогою піску, вогнегасників або спеціальних азбестових ковдр. У домашніх умовах, щоб загасити предмети, які горять, або одяг, що загорівся на людині, треба накинути на них ковдру, килим або покривало та щільно загорнути, щоб припинити доступ повітря.
3). Соляна кислота є основним неорганічним компонентом шлункового соку є. Вона кислота активує ферменти, що розщеплюють білки. За деяких порушеннях функції шлунку вміст у шлунковому соку соляної кислоти може підвищуватися, тоді лікарі призначають лікарський засіб Маалокс. Основним діючим компонентом засобу є магній гідроксид.
Опишемо хімічним рівнянням процес, який відбувається у шлунку.
Mg(OH)2+2HCl→MgCl2+H2O, (реація нейтралізації)
4). У 1774 році протестантський священник, глибоко зацікавлений хімією, Джозеф Прістлі проводив досліди: вчений помістив цегляно-червону «окалину» ( меркурій (ІІ) оксид HgO) в пробірку та нагрівав її. У верхній частині пробірки з’являлися блискучі кульки металу та виділявся газ із незвичайними властивостями. Речовини в цьому газі горіли швидше та яскравіше, ніж на повітрі. Записом відповідного рівняння відобразіть дослід Прістлі.
2HgO = 2Hg + O2↑, (реакція розкладу)
V. Повторення вивченого матеріалу
а)

б) Обчисліть кількість речовини солі, що утвориться від взаємодії купрум(ІІ) оксиду масою 16г з сульфатною кислотою.
VI. Рефлексія
На уроці я:
- дізнався…
- навчився…
- найбільший мій успіх – це…
- найбільші труднощі я відчув…
- на наступному уроці я хочу…
VII. Домашнє завдання
Опрацювати §18 Виконати вправи №73, 74, 75 (2), ст. 97.


про публікацію авторської розробки
Додати розробку
