Конспект уроку "Ідеальний газ. Тиск газу. Основне рівняння молекулярно-кінетичної теорії ідеального газу."
Тема. Ідеальний газ. Тиск газу. Основне рівняння молекулярно-кінетичної теорії ідеального газу.
Мета уроку:
Освітня. Ввести поняття ідеального газу. Ознайомити з основним рівнянням молекулярно-кінетичної теорії ідеального газу (рівнянням Клаузіуса). Відпрацювати навички розв’язування задач.
Розвиваюча. Розвивати логічне мислення, творчу уяву та фізичну компетентність.
Виховна. Виховувати культуру оформлення розрахункових задач.
Формування ключових компетентностей:
♦ Математична грамотність.
♦ Компетентності в природничих науках і технологіях.
♦ Уміння навчатися впродовж життя.
Обладнання: ноутбук, проектор, екран, презентація, відео: «Рух молекул газу», «Броунівський рух», «Дифузія», програма «Phet» (відеосимулятор), програма для тестування «MyTest», повітряні кульки
Тип уроку:вивчення нового матеріалу.
Хід уроку
І. Організаційний момент.
Вчитель. Доброго дня всім!
Погляньте за вікно. Надворі – зима! Вона може бути різною: сонячною, теплою, а може бути холодною, сніжною, морозною. Одним словом, мінлива пора року! Хочу, щоб ваші знання, отримані сьогодні на уроці, були не мінливими, а постійним й міцними.
Один відомий вчитель сказав, щоб плідно працювати на уроці, необхідно прогнати з уроку бога сну Морфея і частіше запрошувати Мамуса – бога сміху. Щоб у всіх був позитивний настрій на уроці я підготувала для вас невеличкий сюрприз. Пропоную вам послухати загадку, а її відгадка допоможе вам здогадатись, що знаходиться у цій чарівний коробці.
Я іду за першим вслід,
У відомій всім таблиці.
Я – це з космосу привіт,
Бо мене знайшли на сонці,
Хоч я є і за віконцем.
… є також в повітрі,
У швидкому льоті вітру. (Гелій)
Пам'ятка на урок (Слайд 1)
- Посміхніться вчителям, гостям, однокласникам.
- Будьте уважні та доброзичливі.
- Гарний настрій та володіння собою допоможуть бути активними на уроці.
- Аналізуйте та порівнюйте нове, не бійтеся помилитися, продемонструйте пам’ять, уяву та досвід.
- Робіть самостійні висновки.
- Зичу вам успіху.
ІІ. Актуалізація опорних знань.
Вчитель.
«Ніколи не беріться за наступне, не засвоївши попереднього» - застерігав відомий фізіолог І. П. Павлов. То ж давайте повторимо матеріал, який ви засвоїли на попередніх уроках.
- Інтерактивна вправа «Снігова грудка» (Слайд 2)
Алгоритм прийому: слово – речення – питання – відповідь.
Учитель звертається до учня і говорить: «Слово!» Той промовляє слово, яке стосується теми уроку і говорить: «Речення». Другий учень складає речення з цим словом. Третій учень придумує питання до цього речення, четвертий відповідає на нього. Наприклад,
|
Слово |
Роберт Броун. |
|
Речення |
Англійський ботанік. |
|
Питання |
Що таке броунівський рух? |
|
Відповідь |
Це тепловий рух завислих у рідині або газі частинок. |
Слова: атом, Амадео Авогадро.
- Інтерактивна вправа «Пазли» (Слайд 3)
На дошці числа від 1 до 10 за якими міститься пазл назва теми уроку. Учні вибирають число. Під числом міститься запитання. Учні відповідають на запитання. Після правильної відповіді відкривається зашифрована частинка пазла.
- Сформулюйте основні положення МКТ.
- Чи мають гази власний об’єм?
- Який рух ви спостерігали? Доказом яких положень є броунівський рух? (відео-запитання)
- Яке явище ви спостерігали? Що таке дифузія? (відео-запитання)
- Чи є правильним твердження, що швидкість руху молекул певних газів за однакової температури є однаковими?
- Яку величину позначають цією буквою?(кількість речовини). За якою формулою розраховують? В яких одиницях вимірюють?
- Що таке молярна маса? Як її позначають? За якою формулою розраховують? В яких одиницях вимірюють?
- За поданими фотографіями назвіть де який агрегатний стан та вкажіть особливості розміщення та руху молекул в різних агрегатних станах.(фото-запитання)
Отже, за допомогою ваших відповідей ми склали пазл, який є темою нашого уроку.
Тема. Ідеальний газ. Тиск газу. Основне рівняння молекулярно-кінетичної теорії ідеального газу
ІІІ. Мотивація теми і мети заняття: повідомлення та запис теми.
Метод «Прес» (Слайд 12)
Запитання до класу:
Як ви думаєте чому важливо вивчати властивості речовин, газів, уміти описувати процеси, які в них відбуваються? Обґрунтуйте відповідь, використовуючи попередньо набуті знання з фізики та власний життєвий досвід. (Щоб вміти розпізнати та відрізнити одні речовини від інших, щоб правильно поводитися з речовинами, з користю для себе їх використовувати й не завдавати шкоди навколишньому середовищу, бо фізичні властивості речовин обумовлюють їхнє застосування.)
Вчитель.
На попередніх уроках ви знайомилися з відкриттями відомих вчених-фізиків, з історією дослідження властивостей газів, а сьогодні на уроці продовжимо вивчати властивості газів.
Отже, запишіть, будь ласка, у зошити
27 лютого
Класна робота
Ідеальний газ. Тиск газу. Основне рівняння молекулярно-кінетичної теорії ідеального газу
Отже, на сьогоднішньому уроці ми розглянемо дуже складні та цікаві питання: (Слайд 13)
- Вивчимо поняття ідеального газу як фізичної ідеалізації та умови його існування.
- Ознайомимось з основним рівнянням молекулярно-кінетичної теорії ідеального газу (рівнянням Клаузіуса).
- Навчимось розв’язувати задачі на рівняння молекулярно-кінетичної теорії ідеального газу (рівнянням Клаузіуса).
ІV. Вивчення нового матеріалу
1. Поняття ідеального газу як фізичної ідеалізації.
З трьох агрегатних станів, в яких може перебувати речовина, найбільш простим для вивчення є газоподібний.
Переглянемо відео і скажете чому ж газоподібний стан найбільш простіше вивчати? (Слайд 14)
Частинки в газах, на відміну від рідин і твердих тіл, розташовуються одна відносно одної на відстанях, що суттєво перевищують їх власні розміри. В цьому випадку взаємодія між молекулами мала і кінетична енергія молекул набагато більша енергії міжмолекулярної взаємодії. Для з'ясування найбільш загальних властивостей, притаманних усім газам, використовують спрощену модель газу - ідеальний газ (Слайд 15)
Відкрийте підручник на ст.. 172 і знайдіть, будь ласка, що таке ідеальний газ?
Ідеальний газ — це газ, взаємодією між молекулами у якому можна знехтувати. (Слайд 16)
За яких умов газ можна вважати ідеальним? Знайдіть у підручнику.
Газ можна вважати ідеальним, якщо: (Слайд 17)
- відсутні сили міжмолекулярної взаємодії, тобто молекули не притягаються і не відштовхуються;
- взаємодія між молекулами відбувається тільки під час їх зіткнень і є пружною;
- молекули газу вважаються матеріальними точками.
2. Умови, за яких реальні гази можна вважати ідеальними.
У природі такого газу не існує, але близькими за властивостями можна вважати реальні розріджені гази (азот, кисень), тиск у яких на перевищує 200 атм і які перебувають за не дуже низької температури.
Запитання:
- Чому гази за високої температури можна вважати ідеальними?
(Чим вища температура газу, тим більша унаслідок теплового руху молекул відстань між ними порівняно з розмірами, а отже, газ ближчий до ідеального).
- Чому за високого тиску властивості реальних газів відрізняються від властивостей ідеального?
(За високого тиску молекули газів розміщуються на відстанях, які приблизно дорівнюють діаметрам самих молекул: при цьому їх уже не можна вважати матеріальними точками, отже, такий газ не можна вважати за ідеальний.)
3.Основне рівняння МКТ газів.
Стан газу описують за допомогою певних величин, які називають параметрами стану. Розрізняють: (Слайд 18)
-
Величини, що визначають поведінку однієї частинки в системі, називаються мікроскопічними параметрами (масa
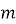 , швидкість
, швидкість 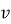 , кінетична енергія молекули
, кінетична енергія молекули 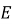 ).
).
-
Величини, які характеризують систему в цілому, називають макроскопічними параметрами (об'єм
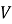 , тиск
, тиск 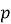 , температура
, температура 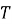 ).
).
Задача МКТ полягає в тому, щоб встановити зв'язок між мікроскопічними і макроскопічними параметрами. Використовуючи модель ідеального газу, обчислимо тиск газу на стінку посудини.
Тиск виникає внаслідок ударів молекул о стінки посудини.
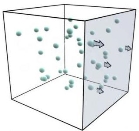 Нехай газ міститься в закритій посудині. Маса кожної молекули -
Нехай газ міститься в закритій посудині. Маса кожної молекули - ![]() , їх число дорівнює
, їх число дорівнює ![]() , і вони рухаються зі швидкістю v (очевидно, що швидкості у всіх молекул різні, проте середнє значення модуля швидкості v цілком певне). При кожному ударі молекули діють на стінку посудини з деякою силою. Поєднуючись один з одним, сили ударів окремих частинок утворюють деяку силу тиску, що постійно діє на стінку, а значить і тиск. (Слайд 19)
, і вони рухаються зі швидкістю v (очевидно, що швидкості у всіх молекул різні, проте середнє значення модуля швидкості v цілком певне). При кожному ударі молекули діють на стінку посудини з деякою силою. Поєднуючись один з одним, сили ударів окремих частинок утворюють деяку силу тиску, що постійно діє на стінку, а значить і тиск. (Слайд 19)
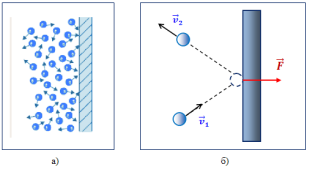
Тиск газу залежить: (Слайд 20)
- від маси: чим більша маса молекули, тим сильніший удар, значить тут пряма пропорційна залежність тиску від маси;
- від швидкості: чим швидше рухаються молекули, тим сильніші будуть удари, а значить і більший тиск;
- є ще одна залежність від швидкості: чим швидше рухаються молекули, тим частіші удари, а значить і більший тиск;
- тиск газу залежить від кількості молекул в даній посудині, а точніше від концентрації ![]() .
.
Концентрація – фізична величина, що дорівнює числу молекул, що містяться в одиниці об'єму: (Слайд 21)
![]()
В результаті отримуємо: тиск газу прямо пропорційний концентрації частинок, масі частинки і квадрату швидкості частинки: (Слайд 22)
![]()
Це і є основне рівняння молекулярно-кінетичної теорії ідеального газу. У цьому рівнянні коефіцієнт 1/3 означає, що в тривимірному просторі лише третина молекул бере участь в русі в певному напрямку (по осі х, наприклад).
Зв'язок тиску із середньою кінетичною енергією молекул.
Якщо праву частину рівняння помножити і поділити на 2, то ми отримаємо ще один запис рівняння МКТ: (Слайд 23)
![]() ,
,
так як ![]()
то ми можемо записати основне рівняння МКТ у вигляді:
![]() ,
,
Отже, тиск ідеального газу пропорційний добуткові концентрації молекул на середню кінетичну енергію поступального руху молекули.
Основне рівняння МКТ (рівняння Клаузіуса) вважають містком між двома підходами в тлумаченні теплових явищ і процесів - термодинамічним і молекулярно-кінетичним.
V. Закріплення знань
(одну задачу учень розв’язує біля дошки (колективно), в той час декілька учнів розв’язують задачі на картках (самостійно))
- Розв’язування задач
Задача 1. Концентрація молекул у балоні з газом ![]() м-3, тиск
м-3, тиск ![]() Па. Чому дорівнює середня кінетична енергія
Па. Чому дорівнює середня кінетична енергія ![]() однієї молекули? (Слайд 24)
однієї молекули? (Слайд 24)
![]() Дано: Розв’язання:
Дано: Розв’язання:
![]() м-3
м-3 ![]() ;
;
![]() Па
Па ![]() ;
;
![]()
![]()
![]() .
.
Відповідь: ![]() .
.
Задача 2. Знайти концентрацію молекул водню у балоні, якщо тиск 240 Па, а середня квадратична швидкість його молекул 240 м/с. (Слайд 25)
![]() Дано: Розв’язання:
Дано: Розв’язання:
![]() м/с
м/с ![]() , де
, де
![]() Па
Па ![]() ;
;
![]() кг/моль
кг/моль ![]() ;
;
![]()
![]()
![]() .
.
Відповідь: ![]() .
.
Задача 3. Середня квадратична швидкість молекул деякого газу 100 м/с . Тиск газу 40 кПа. Знайти густину газу за таких умов.
![]() Дано: Розв’язання:
Дано: Розв’язання:
![]() м/с
м/с ![]() ;
;
![]()
![]()
![]() ;
;
![]() ;
;
![]() ;
;
![]() =1,2 кг/м3.
=1,2 кг/м3.
Відповідь: ![]() =1,2 кг/м3 .
=1,2 кг/м3 .
- Тест «Ідеальний газ» (виконання тесту в тестовій програмі «MyTest») (Слайд 26)
Для того, щоб перевірити як ви зрозуміли та засвоїли сьогоднішню тему я пропоную вам виконати тестові завдання.
1. Дано такі параметри газу: тиск, об'єм, температура, середня квадратична швидкість руху молекул, маса молекули, густина. Які з цих параметрів є макроскопічними?
А) Температура, середня квадратична швидкість руху молекул, маса молекули.
Б) Середня квадратична швидкість руху молекул, маса молекули, густина.
В) Тиск, об'єм, середня квадратична швидкість руху молекул.
Г) Тиск, об'єм, температура.
Д) Тиск, маса молекули, густина.
2. Як зміниться тиск ідеального газу, що міститься в закритій посудині, якщо внаслідок нагрівання середня квадратична швидкість руху його молекул збільшиться у 2 рази?
А) Збільшиться в 4 рази
Б) Збільшиться в 2 рази
В) Зменшиться в 4 рази
Г) Зменшиться в 2 рази
3. Унаслідок стискання об'єм ідеального газу зменшився в 2 рази, а середня кінетична енергія його молекул збільшилася в 3 рази. Як змінився тиск газу?
А)Зменшився в 2 рази
Б)Зменшився в 3 рази
В)Збільшився в 3 рази
Г)Збільшився в 2 рази
Д)Збільшився в 6 раз
4. За однакової температури швидкість дифузії в газі...
А)...менша, ніж у рідині
Б)...менша, ніж у твердому тілі
В)...більша, ніж у рідині
Г)...така ж, як у твердому тілі
5. Газ, що складаєься з молекул, які не взаємодіють між собою, називають
А) розрідженим
Б) ідеальним
В) реальним
6. Основне рівняння МКТ ідеального газу має вигляд:
А)![]()
Б) ![]()
В) ![]()
7. Основне рівняння молекулярно-кінетичної теорії ідеального газу встановлює зв'язок між:
А) середньою квадратичною швидкістю, концентрацією молекул й тиском газу
Б) об'ємом та кількістю молекул газу
В) концентрацією молекул і температурою газу
Г) температурою, тиском газу та об'ємом
8. Як зміниться тиск газу в посудині ,якщо збільшиться концентрація молекул газу:
А) збільшиться
Б) зменшиться
В) не зміниться
VІI. Підсумок уроку. Оцінювання.
Вправа «Продовж речення» (Слайд 27)
- Сьогодні я дізнався…
- Було цікаво…
- Було складно…
- Я зрозумів, що…
- Тепер я зможу…
- Я навчився…
- У мене вийшло …
- Я зміг…
Сьогодні на уроці ви одержали додатковий життєвий досвід. Сподіваюся, що знання і уміння отримані на уроці, допоможуть вам краще орієнтуватися в навколишньому світі, а фізичні явища стануть для вас більш зрозумілими і привабливими.
Оцінювання учнів
VI. Повідомлення домашнього завдання. (Слайд 28)
Вчитель:Запишіть у зошити домашнє завдання:
1. Вивчити §28
2. Повторити §10
3. Виконати завдання 1-2 (усно), 3 (письмово) вправа №28
4. Виконати завдання 4 (письмово) вправа №28
Урок закінчено. Дякую за увагу! (Слайд 29)
1

про публікацію авторської розробки
Додати розробку
