Конспект уроку "Молярна маса"
Конспект уроку з хімії 8 клас по розділу «Кількість речовини. Розрахунки за хімічними формулами».
Тема уроку. Молярна маса.
Мета: сформувати поняття про молярну масу, одиниці її вимірювання. Пояснити сутність величини молярної маси. Навчити встановлювати взаємозв’язок між молярною масою та кількістю речовини; обчислювати молярну масу за відомим значення кількості речовини та її масою і навпаки.
Розвивати вміння порівнювати, узагальнювати отримані знання та робити висновки.
Виховувати самостійність, наполегливість у виконанні вправ.
Тип уроку: комбінований.
Хід уроку.
І. Організаційний момент.
ІІ. Актуалізація опорних знань. Перевірка домашнього завдання.
Хімічний диктант.
- Фізична величина, що вказує на число структурних частинок, які містяться в даній порції цієї речовини, називається…….. ( кількість речовини).
- Одиницею вимірювання кількості речовини є …… (моль).
-
Чому дорівнює стала Авогадро….. (
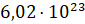 моль-1).
моль-1).
-
Напишіть формулу для визначення кількості речовини……(
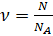 )
)
-
Як позначається стала Авогадро?.... (
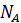 )
)
Рішення тестових завдань.
- Вкажіть число молекул, що міститься у карбон (IV) оксиді, кількість речовини якого становить 1 моль:
а) ![]() ; б)
; б) ![]() ; в)
; в) ![]() ; г)
; г) ![]() ; д)
; д) ![]()
2. Обчисліть і вкажіть кількість речовини кисню, у якій міститься ![]() атомів Оксигену:
атомів Оксигену:
а) ![]() ; б)
; б) ![]() ; в)
; в) ![]() ; г)
; г) ![]() ; д)
; д) ![]()
3. Встановіть відповідність між кількістю молекул газу та кількістю атомів, які містяться у цій кількості молекул.
|
А) |
1. |
|
Б) |
2. |
|
В) 1,505 |
3. |
|
Г) |
4. |
|
|
5. |
ІІІ. Мотивація навчальної діяльності.
Чому дорівнює маса 1 моль речовини?
V. Вивчення нового матеріалу.
Молярна маса – це фізична величина, яка дорівнює відношенню маси речовини до її кількості.
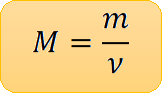
У міжнародній системі вимірювання молярна маса вимірюється у кг/моль. У розрахунках, якщо маса речовини вимірюється в грамах, в г/моль.
Молекулярна маса дорівнює відносній молекулярній масі складної речовини або відносній атомній масі простої речовини.
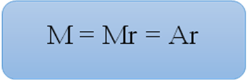
Наприклад, Mr (H2O) = n Ar (H) + n Ar (O) = ![]() , тоді
, тоді
Mr = M = 18 г/моль.
Молярна маса простої речовини: М = Ar (Fe) = 56 г/моль
Завдання. Заповнити таблицю.
|
Речовина |
Mr |
M |
Маса 1 моль |
|
Кисень (О2) |
32 |
32 г/моль |
32 г |
|
Карбон (IV) оксид (СО2) |
44 |
44 г/моль |
44 г |
|
Вода (Н2О) |
18 |
18 г/моль |
18 г |
|
Натрій (Na) |
23 |
23 г/моль |
23 г |
На основі хімічної формули та понять «кількість речовини», «молярна маса» можна здійснювати розрахунки:
-
Обчислити молярну масу речовини.
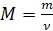
-
Масу даної кількості речовини.
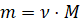
-
Кількості речовини за відомою масою.
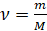
Таким чином, для розв’язування задач будемо використовувати такі формули:
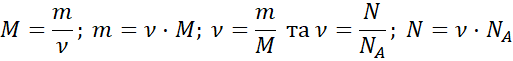

IV. Закріплення вивченого матеріалу.
- Заповнити таблицю.
|
Задано |
Mr |
M |
Маса 1 моль |
Число молекул |
|
|
|
|
|
|
|
|
|
|
|
|
- Самостійна робота.
|
І варіант |
ІІ варіант |
ІІІ варіант |
m(H2O) = 100 г Знайти: υ-? N - ? |
m(H2SO4) = 100 г Знайти: υ-? N - ? |
m (Na2CO3) = 100 г Знайти: υ-? N - ? |
|
2) Дано: υ (Fe2O3) = 0,2 моль Знайти: m -? N - ? |
2) Дано: υ (H2SO4) = 3 моль Знайти: m -? N - ? |
2)Дано: υ (K2 SO4) = 0,5 моль Знайти: m -? N - ? |
|
3) Дано:
N (Na2O) = Знайти: m -? υ - ? |
3) Дано:
N (Mg(OH)2) = Знайти: m -? υ - ? |
3) Дано:
N (Fe2O3) = Знайти: m -? υ - ? |
- Робота біля дошки.
- Яка маса фосфору (V) оксиду кількістю речовини 3 моль?
- Яка кількість речовини барій оксиду масою 168 г?
- Яка кількість молекул міститься у а) 5 моль води; б) 9 г води?
V. Підсумок уроку. Оцінювання.
VI. Домашнє завдання. Вивчити параграф підручника. Вправи для закріплення знань.


про публікацію авторської розробки
Додати розробку
