Конспект уроку на тему "Склад і будова білків. Біологічна роль амінокислот та білків "
Тема заняття: Склад і будова білків. Біологічна роль амінокислот та білків
Амінокислоти – структурні компоненти, з яких побудовано білки. Розглядаючи біоло-гічні функції амінокислот, необхідно відмітити, що амінокислоти приймають участь в ут-воренні багатьох низькомолекулярних сполук в організмі (-аміномасляна кислота), гормонів амінокислотної природи (трийодтиронін, адреналін), є попередниками основ, які входять до складу нуклеїнових кислот та порфіринів, необхідних для біосинтезу гемоглобіну.
У складі природних білків зустрічається 20 амінокислот. Усі амінокислоти, які входять до складу білків, є амінопохідними карбонових кислот, у яких один атом Гідрогену в ради-калі при атомі -Карбону заміщений на аміногрупу. Наприклад:
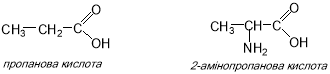
Усі амінокислоти об’єднані загальною ознакою – наявністю вільної карбоксильної групи та вільної незаміщеної аміногрупи при атомі -Карбону. Поміж цих двох функціональних груп, кожна амінокислота має характерний тільки для неї радикал. Загальну будову -аміно-кислот можна навести у вигляді схеми:
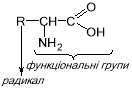
Деякі амінокислоти не можуть синтезуватися в організмі людини та повинні потра-пляти разом з їжею. Вони мають назву незамінних, до них відносять: валін, ізолейцин, лей-цин, метіонін, триптофан, треонін, лізин, фенілаланін, тирозин, цистеїн.
Інші амінокислоти в організмі синтезуються та мають назву замінних – це аланін, аспа-рагін, аспарагінова, гідроксилізин, гідроксипролін, гліцин, глутамінова, глутамін, пролін, се-рин. До напівзамінних відносять аргінін та гістидин.
Амінокислотам притаманні амфотерні властивості, оскільки аміногрупа має основ-ний характер, а карбоксильна – кислотний.
Повний (сумарний) заряд амінокислоти залежить від рН, тобто, від концентрації Н+-йонів у розчині. Значення рН, при якому сумарний заряд амінокислоти дорівнює нулю (у водних розчинах інтервал рН від 4 до 9) має назву ізоелектричної точки (амінокислота не переміщується в постійному електричному полі). При цьому амінокислоти існують переваж-но у вигляді біполярних йонів, або цвіттер-йонів:
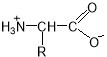
Одна з важливих властивостей амінокислот – це їх здатність вступати в реакцію полі-конденсації з виділенням молекули води та утворенням ковалентного пептидного зв’язку, у якому беруть участь тільки функціональні групи сусідніх амінокислот. Наприклад:
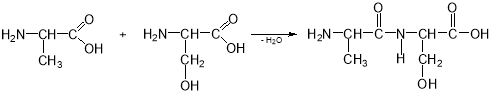
дипептид
До дипептиду аналогічно можуть приєднуватися інші амінокислоти з утворенням три-, тетра-, пента- й т.д., до великого поліпептиду – білка.
Білки – це високомолекулярні нітрогенвмісні органічні сполуки, які побудовано з вели-кої кількості залишків амінокислот, сполучених між собою пептидними (кислотно-амідни-ми) зв’язками в поліпептидні ланцюги, які мають складну структурну просторову органі-зацію та виконують найважливіші функції в живих організмах. У їх складі також зустрічає-ться – Фосфор, Йод, Ферум, Купрум, Магній.
Білкам належить значна роль у структурі та функціях живих організмів. Тканини люди-ни і тварин містять від 10% до 20% білків. Білки виконують ряд біологічних функцій:
структуроутворююча – структурні білки відповідають за підтримання форми та стабіль-ності клітин і тканин (до цих білків відносяться колаген, еластин);
транспортна, наприклад, гемоглобін еритроцитів переносить оксиген та карбон діоксид між легенями та тканинами;
захисна – імунна система захищає організм від збудників хвороб, у якості ключового ком-поненту цієї системи виступають імуноглобуліни;
регуляторна, деякі білки є гормонами (інсулін, соматотропін);
ферментативна – білки є біологічними каталізаторами, здійснюючи в організмі метаболіч-ні реакції;
рухова – білки актин та міозин приймають участь в процесах скорочення та розслаблення м’язів;
запасна, наприклад, у рослинах містяться запасні білки, які є цінними поживними речови-нами; в організмі тварин м’язові білки слугують резервними поживними речовинами, які мобілізуються при необхідності.
Розрізняють чотири рівні організації білкової молекули – первинна, вторинна, третинна і четвертинна структури білка.
Первинна структура – це кількість, якість та порядок розміщення залишків аміно-кислот у поліпептидному ланцюзі, розташованому в просторі. Основу первинної структури складають пептидні зв’язки. Уперше цю гіпотезу висловив А.Я. Данилевський (1888 р.), по-тім підтвердив Е. Фішер, здійснюючи синтез пептидів.
Вторинна структура – це просторова конфігурація поліпептидного ланцюга. У виник-ненні спіральних ділянок білка приймають участь водневі та дисульфідні зв’язки. Існують -спіраль та -складчаста структура.
Третинна структура – це об’ємна тривимірна конформація поліпептидного ланцюга. Основними хімічними зв’язками, які виникають при формуванні третинної структури, є слабкі ван-дер-ваальсові зв’язки, естерні, йонні, дисульфідні та водневі.
Четвертинна структура білка виникає внаслідок сполучення декількох білкових суб-одиниць, які мають первинну, вторинну та третинну структури, у макромолекулу, єдину в структурному та функціональному відношеннях. Для четвертинної структури деяких білків характерне глобулярне розташування субодиниць (гемоглобін), для інших об’єднання в спі-ральні четвертинні структури за типом гвинтової симетрії (вірус тютюнової мозаїки).
Розрізняють білки прості та складні. Прості білки складаються тільки з α-амінокис-лотних залишків, а складні мають ще не амінокислотні компоненти – гем, похідні вітамінів, ліпідні або вуглеводні. До простих відносяться альбуміни, глобуліни, проламіни, гістони.
У складних білках – два компоненти – простий білок та небілкова речовина – сполучені між собою ковалентними або слабкими (йонними, водневими та ін.) зв’язками. До складних білків відносять нуклеопротеїни, хромопротеїни (металопротеїни), фосфопротеїни, гліко-протеїни.
Білки під впливом фізичних (температура, ультразвук, йонізуюча радіація), хімічних (мінеральні та органічні кислоти, луги, органічні розчинники, солі важких металів, алкало-їди) та біологічних (дія протеолітичних ферментів) факторів зазнають глибоких змін, які по-в’язані з порушенням четвертинної, третинної і навіть вторинної структури, що призводить до порушень фізико-хімічних та біологічних властивостей білка, а саме до денатурації. При денатурації білків відмічається розрив зв’язків (водневих, дисульфідних, електростатичних, естерних, ван-дер-ваальсових та ін.). Це призводить до зміни просторової структури та змен-шення її гідрофільних властивостей. Білок стає більш гідрофобним, втрачає здатність розчи-нятися у звичайних для нього розчинниках та свої біологічні функції. Такий вид денатурації вважається незворотним на відміну від зворотного.
Перелік питань до самостійної підготовки.
- Дати визначення амінокислотам, їх поширення у природі.
- Біологічні функції амінокислот.
- Замінні та незамінні амінокислоти.
- На конкретному прикладі пояснити подвійну будову амінокислот.
- Пептидний зв’язок, механізм його утворення.
- Визначення поняття білків, їх будова.
- Біологічні функції білків.
- Структури білків. Навести характерні типи зв’язків для кожної структури.
- Денатурація білків. Пояснити, які зміни відбуваються при цьому в білковій молекулі.
10. Фактори денатурації.
11. Білки прості та складні, навести приклади.
12. Застосування амінокислот і білків.

про публікацію авторської розробки
Додати розробку
