Конспект уроку: Окисно-відновні реакції. Процеси окиснення та відновлення, окисники та відновники.
|
Тема |
Окисно-відновні реакції. Процеси окиснення та відновлення, окисники та відновники. |
|
Мета |
Ознайомити учнів з окисно-відновними реакціями, визначити місце окисно-відновних реакцій серед основних типів хімічних реакцій; сформувати поняття про процеси окиснення й відновлення, про окисники та відновники; сформувати і розвивати уміння порівнювати окисно-відновні реакції методом електронного балансу; виховувати творче ставлення до практичного використання знань. |
|
Обладнання та матеріали |
Періодична система хімічних елементів Д.І.Менделєєва, таблиця відносних електронегативностей хімічних елементів, презентація «Окисно-відновні реакції», комп’ютер, програмно-методичний комплекс навчального призначення для загальноосвітніх закладів «Хімія – 9 клас». |
|
Базові поняття й терміни |
Хімічний зв'язок, електронегативність, валентність, ступінь окиснення, окиснення, відновлення, приймання та віддавання електронів, метод електронного балансу, окисник, відновник. |
|
Тип уроку |
Комбінований. Урок-презентація. |
Структура уроку
I. Організаційний етап
ІІ. Актуалізація опорних знань
ІІІ. Мотивація навчальної діяльності, повідомлення теми, мети і завдань уроку
- Вивчення нового матеріалу
- Відмітні ознаки окисно-відновних реакцій.
- Процеси окиснення і відновлення.
- Складання електронного балансу.
4. Значення окисно-відновних реакцій у природі та техніці.
- Узагальнення та систематизація знань
- Домашнє завдання
VII. Підбиття підсумків уроку
ХІД УРОКУ
І. ОРГАНІЗАЦІЙНИЙ ЕТАП
II. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ
Хімічний диктант (СЛАЙД)
Записати рівняння реакцій, вказати їх типи.
1 варіант 2 варіант
1. SO3 + H2O 1. SO2 + H2O
2. Fe + HCl 2. Al + HCl
3. N2O5 + H2O 3. P2O5 + H2O
4. CaO + HCl 4. MgO + HCl
5. FeO + H2SO4 5. CaO + H2O
6. Cu + H2SO4 6. Na2O + H2SO4
7. CO2 + H2O 7. Hg + H2SO4
8. KOH + H2SO4 8. Cu(OH)2 + HCl
9. Fe(OH)3 9. H2CO3
10. Fe + CuSO4 10. Zn + HgCl2
Бесіда.
- Які ви знаєте типи хімічних реакцій?
- За якими ознаками класифікуються типи хімічних реакцій?
- Дайте визначення ступеня окиснення.
- Чому деякі елементи виявляють різні ступені окиснення?
III. МОТИВАЦІЯ НАВЧАЛЬНОЇ ДІЯЛЬНОСТІ, ПОВІДОМЛЕННЯ ТЕМИ, МЕТИ І ЗАВДАНЬ УРОКУ. (СЛАЙД)
На сьогоднішньому уроці перед вами стоять завдання:
- з’ясувати роль окисно-відновних реакцій у природі, техніці, житті людини;
- удосконалити вміння визначати ступені окиснення, записувати схеми процесів окиснення та відновлення, підбирати коефіцієнти методом електронного балансу.
Нас чекає напружена і цікава робота, девізом якої є слова видатного педагога
Д.І. Писарєва:
Знання складаються з дрібних крихт щоденного досвіду.
IV . ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
1. ВІДМІТНІ ОЗНАКИ ОКИСНО-ВІДНОВНИХ РЕАКЦІЙ.
Розповідь учителя.
Формування поняття «окисно-відновна реакція» відбувається на основі знань про ступінь окиснення. Учням відомо, що якщо електрони атомом віддані, його ступеню окиснення приписується позитивний знак, якщо отримані — негативний знак. У молекулах простих речовин атоми мають ступінь окиснення, який дорівнює нулю, тому що електрони не зміщені до жодного з однакових атомів.
Запишемо рівняння реакції: (СЛАЙД)
Fe 0+Cu+2 SO4 = Fe +2 SO4 + Сu0
У даній реакції змінюються ступені окиснення елементів — це є відмінною рисою окисно-відновних реакцій.
Проблемне питання.
Чим пояснити зміну ступенів окиснення елементів в окисно-відновних реакціях?
Підводимо учнів до розуміння того, що зміна ступенів окиснення пояснюється переходом електронів від одного атома до іншого.
2. ПРОЦЕСИ ОКИСНЕННЯ Й ВІДНОВЛЕННЯ
Розповідь учителя.
У записаному рівнянні реакції можна виділити два протилежні процеси — окиснення й відновлення. (СЛАЙД)
Fe0 - 2e = Fe+2
Cu+2 + 2e = Cu0
Окиснення — це процес віддачі електрона. Відновлення — процес прийому електрона. Атом, що віддає електрони, називається відновником. Атом, що приймає електрони, називається окисником. (СЛАЙД)
Окиснення й відновлення — нерозривні процеси. Електрони передаються від одного атома до іншого і нікуди не зникають, тому окисно-відновна реакція складається з двох процесів — окиснення та відновлення.
3. СКЛАДАННЯ ЕЛЕКТРОННОГО БАЛАНСУ
Розв'язання задач.
На двох трьох прикладах учитель показує порядок складання електронного балансу.
- У записаному рівнянні реакції визначити ступені окиснення всіх елементів.
- Визначити, які елементи в процесі хімічної реакції змінюють ступінь окиснення.
- Записати окремо процеси окиснення та відновлення з указівкою кількості електронів, що беруть участь у кожнім процесі.
- Визначити окисник і відновник.
- Визначити коефіцієнти, на які необхідно помножити рівняння окиснення й відновлення, щоб кількість електронів, відданих відновником і прийнятих окисником, була однаковою.
- Просумувати рівняння окиснення й відновлення з урахуванням отриманих коефіцієнтів або розставити відповідні коефіцієнти у вихідному рівнянні. (СЛАЙД)
Оформлення окисно-відновної реакції з електронним балансом повинно виглядати таким чином:
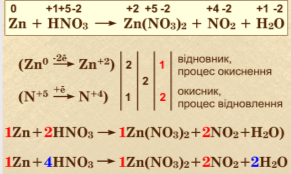
(СЛАЙД)
4. ЗНАЧЕННЯ ОКИСНО-ВІДНОВНИХ РЕАКЦІЙ У ПРИРОДІ ТА ТЕХНІЦІ.
Наше життя постійно супроводжується хімічними реакціями.
Як ви вважаєте, багато чи мало серед них окисно-відновних?
Підводимо до того, що окисно-відновні реакції відіграють важливу роль для живих організмів, у техніці та побуті.
Складаємо схему: (СЛАЙД)
- процеси дихання у тварин
- процес фотосинтезу у рослин
- процес дихання у людини
- металургія
- електроніка
- електротехніка
- енергетика
- косметологія
V. УЗАГАЛЬНЕННЯ ТА СИСТЕМАТИЗАЦІЯ ЗНАНЬ
Завдання.
3і списку рівнянь реакцій учні повинні вибрати окисно-відновні та скласти електронний баланс.
(СЛАЙД)
1 варіант:
KBr + Сl2 → КСl + Вr2;
Zn + HCl → ZnCl2 + H2;
Al(OH)3 + H2SO4 → Al2(SO4)3 + H2O;
Al + S → Al2S3;
NaOH + P2O5 → Na3PO4 + H2O;
2 варіант:
Fe + Cl2 → FeCl3;
NaOH + HCl → NaCl + H2O;
KClO3 + P → KCl + P2O5;
CaO + CO2 → CaCO3;
KCl + F2 → KF + Cl2;
VІ. ДОМАШНЄ ЗАВДАННЯ (СЛАЙД)
- Вивчити §14 підручника .
- Виконати завдання [№ 110; №114*].
VIІ. ПІДБИТТЯ ПІДСУМКІВ УРОКУ.
Використовуємо технологію колективно-групового навчання «Мікрофон», яка надає можливість кожному щось сказати швидко, по черзі, висловлюючи свою думку чи позицію.
Сьогодні на уроці ми:
- дізналися…
- навчилися…
- було цікавого.


про публікацію авторської розробки
Додати розробку
