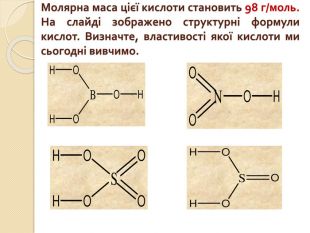
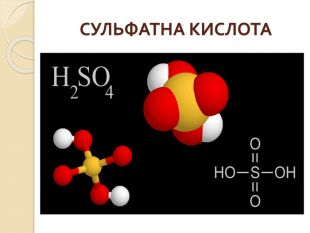
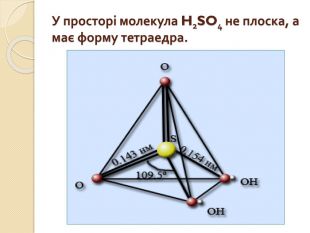
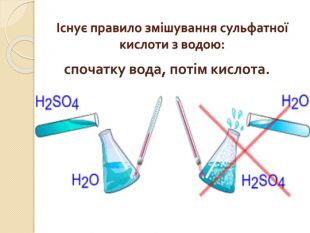
Презентація до уроку з хімії для 10 - го класу на тему "Сульфатна кислота. Сульфати"
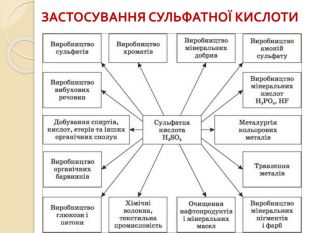
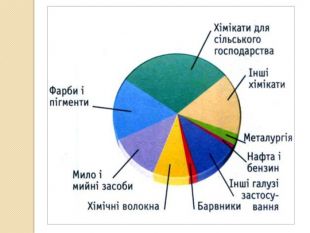
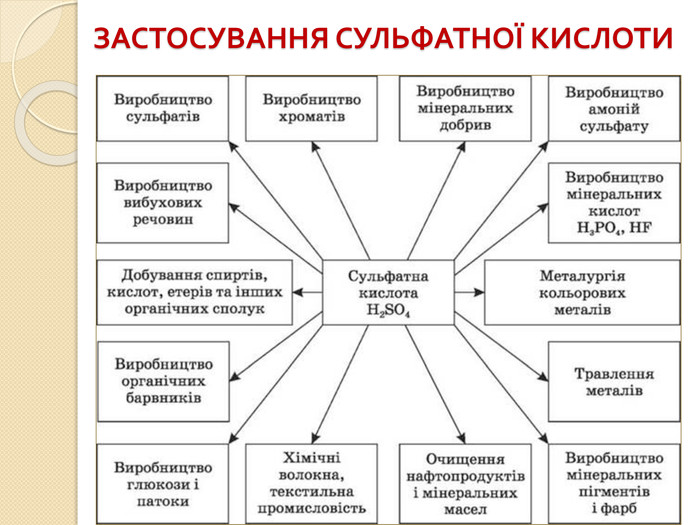
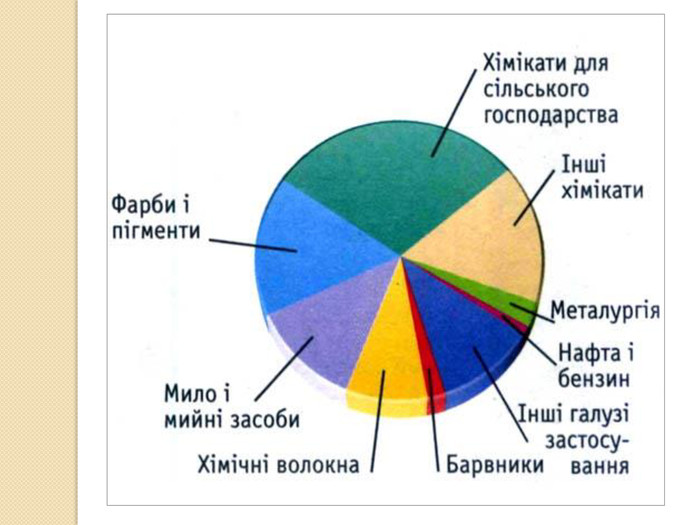
Презентація до уроку з хімії для 10 - го класу на тему "Сульфатна кислота. Сульфати" включає матеріал про властивості сульфатної кислоти та її солей. Презентація містить цікаві факти про поширеність сульфатної кислоти у природі та її застосування у різних галузях народного господарства.



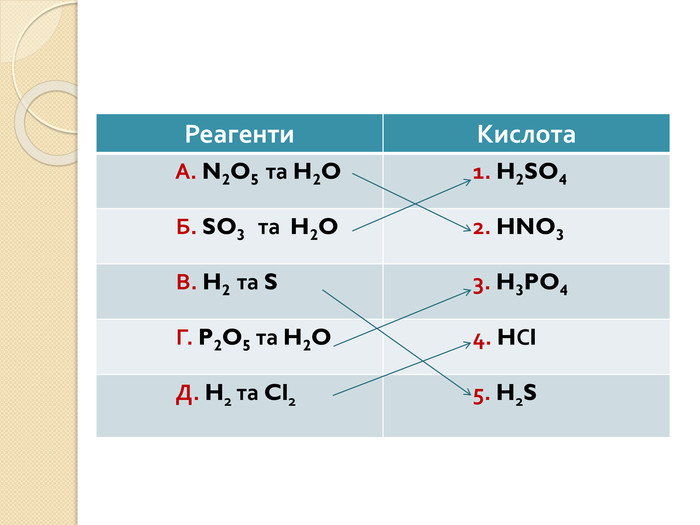



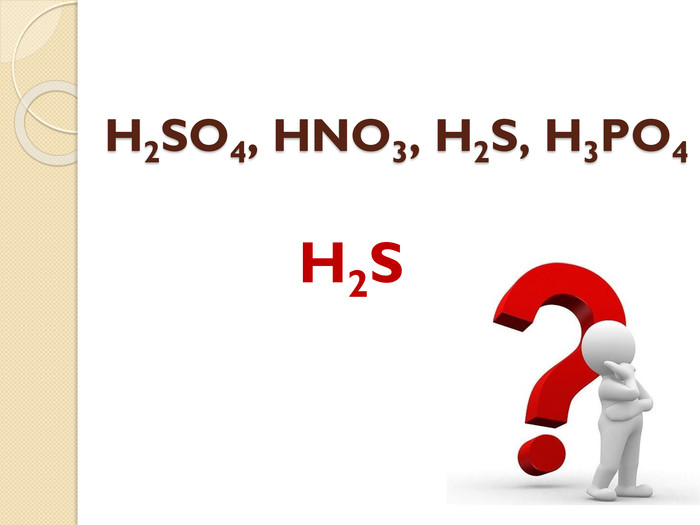




















































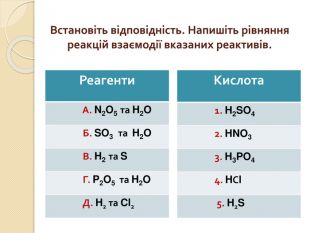
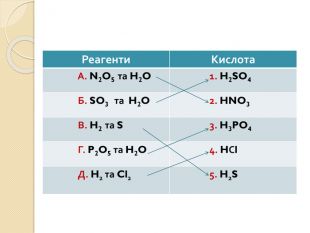
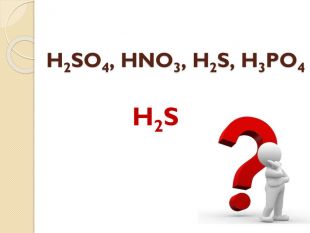
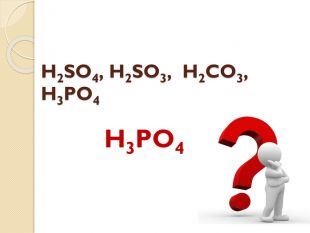
Встановіть відповідність. Напишіть рівняння реакцій взаємодії вказаних реактивів. {5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}Реагенти А. N2 O5 та H2 O Б. SO3 та H2 O В. H2 та S Г. P2 O5 та H2 O Д. H2 та Cl2{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}Кислота 1. H2 SO4 2. HNO3 3. H3 PO4 4. HСl 5. H2 Sstyle.colorfillcolorfill.typefill.onrrrrrstyle.colorfillcolorfill.typefill.onrrrrr
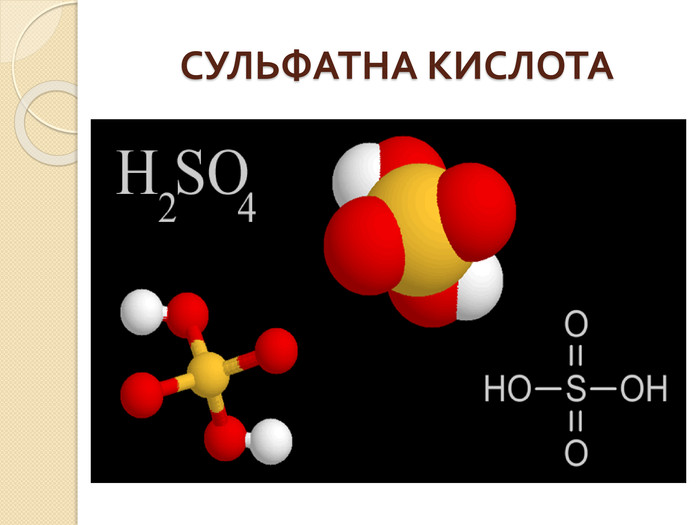
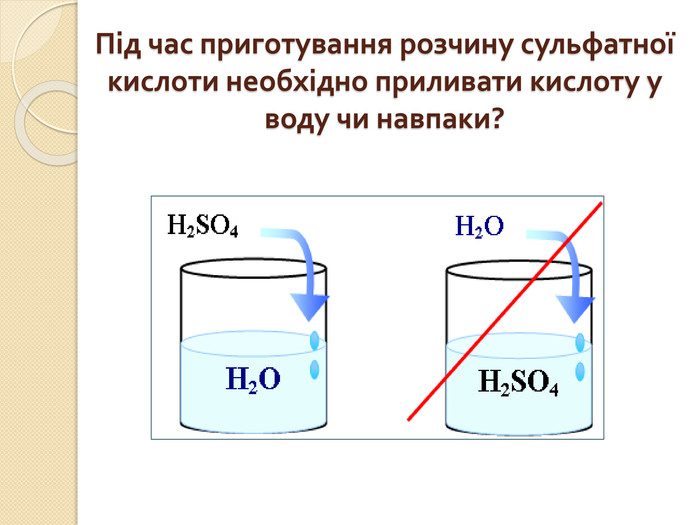
СПЕЦИФІЧНІ ВЛАСТИВОСТІ КОНЦЕНТРОВАНОЇ СУЛЬФАТНОЇ КИСЛОТИКонцентрована сульфатна кислота не дисоціює на іони. Енергійно реагує з водою з утворенням гідратів кислоти. Обвуглює органічні речовини, що містять Карбон і Гідроген. Під час нагрівання діє майже на всі метали до Ag включно (крім Pt, Au та деяких інших).
-
 Крсек Алла Геннадіївна 05.12.2019 в 08:49Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0
Крсек Алла Геннадіївна 05.12.2019 в 08:49Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0


про публікацію авторської розробки
Додати розробку