Конспект уроку з хімії для 7 класу "Хімічні властивості кисню. Поняття про оксиди"
План-конспект уроку з хімії для 7 класу. Урок має на меті ознайомити учнів з хімічними властивостями кисню; закріпити й розширити знання учнів про хімічні реакції, уміння складати рівняння хімічних реакцій; дати уявлення про реакції сполучення, про оксиди як складні речовини.
Тема уроку: Хімічні властивості кисню. Поняття про оксиди
Цілі уроку: ознайомити учнів з хімічними властивостями кисню; закріпити й розширити знання учнів про хімічні реакції, уміння складати рівняння хімічних реакцій; дати уявлення про реакції сполучення, про оксиди як складні речовини.
Хід уроку
- Актуалізація опорних знань
Фронтальне опитування
• Хімічний символ елемента Оксиген. (О)
• Відносна атомна маса. (16)
• Валентність у сполуках. (II)
• Формула простої речовини кисень. (O2)
• У вигляді якої ще простої речовини Оксиген зустрічається в природі? ( O3 — озону)
• Відносна молекулярна маса кисню. (32)
• Відносна молекулярна маса озону. (48)
• Основне джерело одержання кисню в природі. (Фотосинтез)
• Основний спосіб промислового одержання кисню. (Перегонка рідкого повітря)
• Запишіть на дошці основні способи одержання кисню в лабораторії. (Кілька учнів по черзі записують рівняння реакцій одержання кисню.)
• До якого типу належать реакції одержання кисню? (Розкладу)
• Які речовини називаються каталізаторами? (Речовини, що прискорюють реакції, самі при цьому не витрачаючись)
• Що таке інгібітори? (Речовини, що сповільнюють реакції, негативні каталізатори)
• Назвіть основні фізичні властивості кисню.
• В який спосіб можна зібрати кисень?
• Як перевірити наявність кисню в склянці?
• При цьому використовуються фізичні чи хімічні властивості кисню? (Хімічні)
- Мотивація навчальної діяльності
Проста речовина кисень підтримує горіння. Кисню, що міститься в повітрі, досить для горіння дров у багатті, природного газу в грубці, вугілля в каміні тощо. Якщо використовувати для горіння чистий кисень, воно відбувається інтенсивніше.
Розгляньмо процес взаємодії кисню з деякими речовинами, тобто сьогодні ми вивчимо хімічні властивості кисню.
- Вивчення нового матеріалу
- Робота з опорною блок – схемою
Розбір хімічних властивостей кисню:
- Взаємодія з простими речовинами
- Взаємодія зі складними речовинами
- Взаємоперетворення кисню та озону
- Поняття про окиснення, горіння, оксиди, реакції сполучення
Окиснення — це хімічна реакція взаємодії речовин (простих і складних) з киснем.
Вчена казочка про окиснення
- Окисляемся, браток?
- Окисляемся….
- Ну и как оно? Ничего?
- Ничего…
Разговор ведут два полена.
- Что-то ты больно спешишь, это, браток, не по-моему. Окисляться надо медленно, с толком, с пониманием…
- А чего тянуть? Раз – и готово!
- Готово… Это смотря как готово… Ты окисляйся по совести, не почем зря. У меня в этом деле опыт есть. Я уже три года тут окисляюсь!
Окисляются два полена. Одно медленно окисляется, другое быстро. Быстро – это значит горит, медленно – это значит гниет. Вот какие бывают окисления.
Горіння — це хімічна реакція, за якої відбувається окиснення речовин з виділенням тепла і світла.
У більшості випадків у результаті цих реакцій утворюються оксиди.
Оксиди — це складні речовини, що складаються з двох елементів, один з яких — Оксиген з валентністю II.

Доведіть, що в результаті реакції повільного окиснення, як і в
результаті горіння, відбувається виділення тепла
(При розгортанні куч листя восени виділяється пара;
інформація про сорних кур:

В Австралії та на островах Малайського архіпелагу живуть ці великі, з великими сильними ногами птиці, трохи нагадують індичок. У тропічних лісах багато опалого листя, яке швидко розкладається. І сорні кури навчилися виводити своїх пташенят у … інкубаторі. Справжнісінькому, тільки саморобному.
Ще в сухий сезон року вони приступають до спорудження свого інкубатора. Працює тільки самець. Він нагрібає листя в купу, укладає їх. До двох метрів заввишки бувають такі споруди. Швидко піднімається в них температура – і самка кожні три-чотири дні відкладає туди по одному яйцю. Всього їх буває двадцять.
Турбота про інкубатор цілком лежить на самці. Весь день чергує він у гнізда, і не просто вартує його, а весь час працює. То розриває центр купи, щоб яйцям стало прохолодніше, то, навпаки, нагрібає нові листя.)
- Тренувальні вправи
- Серед наведених сполук виберіть тільки оксиди та назвіть їх.
H2SO4, Mg(OH)2, KClO4, CaO, NaOH, SO2, CuCl2, O2, P2O5, CuO, HnO3, MgO, CO2, Al2O3, H3PO4, Fe2O3, Na2O, NaNO3.
- Напишіть рівняння взаємодії кисню з простими речовинами, внаслідок чого утворяться зазначені в схемі оксиди.
Варіант 1. 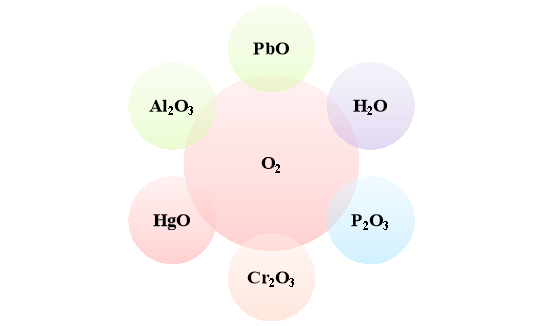
Варіант 2. 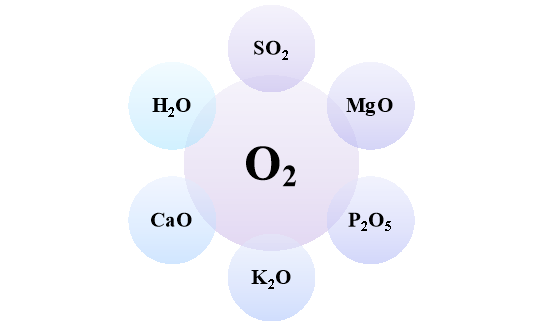

Варіант 3. 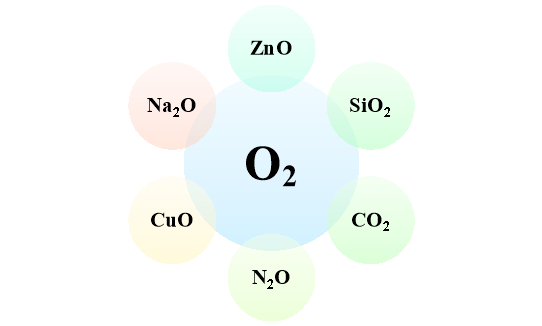
- Закінчіть рівняння реакцій:
H₂S + O₂→
C₃H₈ + O₂→
CH₄ + O₂→
SiH₄ + O₂→
 Окиснення оксидів відбуватиметься у тому випадку, коли елемент в оксиді знаходиться не в найвищій валентності. Максимальна валентність елементів дорівнює номеру групи Періодичної системи, в якій знаходиться елемент, за винятком: Cu - максимальна валентність ІІ, F - валентність завжди І, O – максимальна валентність – ІІ.
Окиснення оксидів відбуватиметься у тому випадку, коли елемент в оксиді знаходиться не в найвищій валентності. Максимальна валентність елементів дорівнює номеру групи Періодичної системи, в якій знаходиться елемент, за винятком: Cu - максимальна валентність ІІ, F - валентність завжди І, O – максимальна валентність – ІІ.
CО + O₂→
P2O3 + O₂ →
CO2 + O₂ →
Cl2O7 + O₂ →
Fe2O3 + O₂ →
FeO + O₂ →
Fe3O4 + O₂ →
- Підбиття підсумків уроку
- Домашнє завдання


про публікацію авторської розробки
Додати розробку
