Конспект уроку з хімії для 7 класу на тему: "Повітря, його склад. Оксиген. Поширеність Оксигену в природі."
№ 25
Дата: _______________
Тема: Повітря, його склад. Оксиген. Поширеність Оксигену в природі. Кисень, склад його молекули, поширеність у природі. Фізичні властивості кисню.
Очікувані результати: учень називає склад молекул кисню, описує поширеність Оксигену в природі; його фізичні властивості.
Тип уроку: вивчення нового матеріалу.
Методи навчання: словесні, наочні, практичні.
Клас: 7 клас.
Адрес точный, если спросят: 32,16,8
(Кислород)
Хід уроку
I. Організаційна частина.
II. Актуалізація опорних знань і мотивація навчальної діяльності.
У попередніх класах ви дізнались про повітря. З деякими його властивостями ознайомилися на уроках природознавства та географії. Тепер ми продовжуємо вивчати повітря у взаємозв’язку відомих вам знань про нього та нового навчального матеріалу, що стосується саме хімії.
IІІ. Вивчення нового матеріалу.
ЧИМ Є ПОВІТРЯ З ПОГЛЯДУ ХІМІКА? З тим, що тіла живої і неживої природи складаються з речовин, ви обізнані. Але речовини бувають різними – чистими й такими, що утворюють суміші, простими і складними, неорганічними та органічними. До яких із них віднести повітря? Розпочнемо зі складу повітря, щоб одержати відповідь на запитання, чистою речовиною чи сумішшю речовин воно є. Вчені встановили, що близько 4/5 об’ємного складу повітря становить газоподібна речовина азот N2, що не має кольору і запаху. На другому місці перебуває кисень О2 – теж газоподібна речовина без запаху й кольору. Третіми за об’ємним вмістом у складі повітря є інертні гази, серед
яких переважає аргон Аr, а на четвертому місці – вуглекислий газ СО2. Тож відповідь однозначна – повітря є природною сумішшю газоподібних речовин. У ньому також міститься водяна пара Н2О та деякі інші речовини, зокрема ті, що утворюють частинки пилу.
Як пов’язані зі складом повітря вранішня роса на траві та туман?
Друге запитання хімічного змісту — до простих чи складних речовин належать компоненти повітря? Погляньте на якісний склад наведених у тексті параграфа формул компонентів повітря і ви побачите серед них три формули простих речовин і дві формули складних. Отже, повітря — це природна газоподібна суміш простих і складних речовин.
І нарешті третє запитання — до неорганічних чи органічних речовин належать компоненти повітря? Безперечно, прості речовини не можуть бути органічними, а вуглекислий газ, хоча й містить Карбон, відносять до неорганічних речовин.
От ми й отримали відповідь на останнє поставлене запитання: складові повітря є неорганічними речовинами.
Повітря — це природна однорідна суміш газоподібних неорганічних речовин азоту, кисню, інертних газів, вуглекислого газу, парів води та в невеликій кількості деяких інших речовин.
КІЛЬКІСНИЙ СКЛАД ПОВІТРЯ.
З’ясувавши якісний склад повітря, розглянемо кількісний, скориставшись діаграмою.
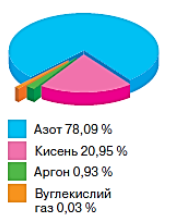
Зверніть увагу, що на два компоненти — азот та кисень — припадає 99 % складу повітря. І наведені дані у тексті параграфа, і діаграма доводять, що основна складова повітря — азот. Походження назви доволі цікаве: «зоо» — життя, префікс «а» — заперечення. Так його спершу назвали через те, що він не бере участі у важливому процесі живої природи — диханні. Однак на сьогодні думка щодо азоту змінилася. Його розглядають як важливу для живої природи речовину. Це тому, що всі білкові молекули у своєму складі містять Нітроген. Близько 1/5 складу повітря припадає на кисень. У тому, що це дійсно так, переконує нескладний дослід. Помістимо в посудину з водою свічку на легкій підставці. Підпалимо ґніт і накриємо свічку циліндром з попередньо розміченим на п’ять рівних частин простором над водою. Поки в циліндрі є кисень — полум’я горить. Під час горіння кисень поступово витрачається, і об’єм, який він займав, заповнює вода. Спостерігаємо, як вода в циліндрі піднімається. Коли кисню в циліндрі не залишиться, свічка згасне. Виявиться, що вода піднялася приблизно на одну поділку
Вуглекислого газу на перший погляд у повітрі дуже мало — менше, ніж неактивних інертних газів. Але, якщо зважати на великий об’єм повітряної оболонки Землі, стає зрозумілим що його цілком достатньо для фотосинтезу.
Тривалий час у хімії існувала думка про повітря як про елемент.
Першим відкрив кисень китайський вчений Мао Хао у VІІІ столітті, який за 1000 років до А. Лавуазьє встановив, що в склад повітря входе газ, підтримуючий горіння і дихання!

Карл Вільгельм Шеєле (1742-1786). Шведський хімік. У 1772 році встановив, що повітря складається з кисню та азоту.

Джозеф Прістлі (1733-1804) – англійський вчений.
У 1774 р. розкладом оксиду ртуті (ІІ) отримав кисень і вивчив його властивості.

Антуан Лавуазьє (1743-1794) – французький хімік. У 1774 р. експериментально довів склад повітря. Дослідив кисень і дав йому назву oxygen.
Заперечив теорію флогістона.
А история простая …
Джозеф Пристли, как-то раз
Окись ртути нагревая,
Обнаружил странный газ.
Газ без цвета, без названья
Ярче в нем горит свеча
А не вреден для дыханья?
(Не узнаешь у врача)
Новый газ из колбы вышел –
Никому он не знаком.
Этим газом дышат мыши
Под стеклянным колпаком.
Человек им тоже дышит
Джозеф Пристли быстро пишет:
«Воздух делится на части».
(Эта мысль весьма нова)
Здесь у химика от счастья
И от воздуха, отчасти,
Закружилась голова …
Кошка греется на крыше,
Солнца луч в окошко бьет.
Джозеф Пристли с ним две мыши
Открывают «КИСЛОРОД».
Вивчення простих речовин ми починаємо з одного з найпоширеніших елементів-неметалів – Оксигену який утворює кисень, що входить у склад повітря.
Повітря
Повітря і не видно, і не чути.
Але без нього нам не обійтись.
Не можна ні хвилиночки пробути.
Ось ти навколо себе подивись.
Все дихає: листочок і травичка,
Метелик, що над квіткою летить.
І дише рибка й рак, і дише річка...
Повітря треба кожному, щоб жить.
А он несуть вітри хмаринку білу,
Щоб дощик на поля й ліси пролить.
А он у небо пташка полетіла,
А без повітря як вона злетить?
Повітря — це велике диво, діти.
І все життя — це казка чарівна.
І кожній миті треба нам радіти,
Земля казкова і у нас одна.
Шведський учений Карл Шеєле, учень аптекаря, у вільний від роботи час займався хімічними дослідами з вивчення флогістону – пальної сутності речовини. Він спалював у закритій колбі фосфор, який миттєво згоряв, перетворюючись на «суху фосфорну кислоту» (Р2О5). Потім занурював колбу в посудину з водою, і вона на 1/5 заповнювалася водою. Знову і знову вчений повторював дослід, спалюючи різні речовини, й одержував одне й те саме – зникала 1/5 частина повітря. Шеєле припустив, що повітря в колбі вже інше. Щоб перевірити свою гіпотезу, він досліджував повітря, що залишилося в колбі. Повітря виявилося мертвим: у ньому нічого не хотіло горіти, свічки стухали, немов їх задмухувала «невидимка», розжарене вугілля остигало, палаюча скіпка миттєво гасла. Висновок був тільки один: повітря – неоднорідна речовина, одна частина якого підтримує дихання і горіння.
Після численних дослідів з розкладу селітри (КNO3, NaNО3.) Шеєле одержав «вогненне повітря», в якому скіпка, що ледь жевріла, загорялася яскравим полум'ям. Шеєле повторив дослід зі спалювання фосфору, але у «вогненному повітрі» після згоряння фосфору колба цілком заповнювалася водою.
Утім, таємниця вогню так і залишалася для вченого таємницею, тому що до кінця днів він залишався прихильником теорії «флогістону». «Вогненне повітря» було відкрите майже одночасно трьома вченими: К. Шеєле, Дж. Прістлі, А. Лавуазьє.
Англієць Джозеф Прістлі сонячним промінням нагрівав у пробірці меркурій(ІІ) оксид і одержував велику кількість газу, в якому свічка яскраво горіла.
Першість у відкритті кисню належить Дж. Прістлі. Але з усіх трьох тільки Лавуазьє правильно оцінив істинне значення кисню в природі. Він уперше заявив, що ніякого флогістону не існує. Ця заява викликала бурю в ученому світі. Хіміки так звикли бачити всюди незримий флогістон, що ніяк не могли розстатися з ним. Але проти очевидного встояти важко, і наприкінці XVIII століття флогістон було остаточно вигнано з хімічної науки.
ВЛАСТИВОСТІ ПОВІТРЯ.
Розглянемо фізичні властивості повітря. Повітря не має кольору й запаху, тому для нас воно невидиме. Та в існуванні його навколо нас легко переконатися. Візьміть аркуш паперу й зробіть ним кілька помахів на відстані 10–15 см від свого обличчя. Ви одразу ж відчуєте рух спрямованого на нього повітря.
Як і все, що існує на Землі, повітря має певну масу. Пересвідчитись у цьому можна за допомогою такого досліду. На кінцях імпровізованих терезів урівноважено дві пус-
ті повітряні кульки (мал. 75а).
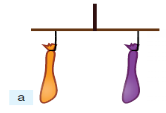
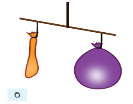
Дослід, який доводить що повітря має масу
Після цього одну з кульок наповнили повітрям, щільно зав’язали ниткою та знову прив’язали до терезів. Рівновага порушилась, шалька з кулькою, наповненою повітрям, опустилася нижче (мал. 75б). Встановлено, що за нормальних умов (температурі 0 °С і тиску 101,33 кПа, або 1 атм.) маса повітря об’ємом 1 л дорівнює 1,29 г, тоді як маса 1 л води — 1000 г (мал. 76).
Обчисліть, у скільки разів повітря легше за воду за нормальних умов.
Для того, щоб перевести газоподібне повітря у рідкий агрегатний стан, необхідна температура –192,0 °С. Як і всі гази та рідини, воно не має власної форми, а тому повністю заповнює простір, який йому доступний. Тобто повітря — всюдисуща суміш газів. Ми говоримо «пуста чашка», «пуста ваза», «пуста пляшка», не замислюючись над тим, що насправді вони «повні», а точніше наповнені повітрям. В цьому переконує занурення пустої пляшки у посудину з водою. Набагато важча за повітря вода витісняє його з пляшки й ми бачимо, як бульбашки повітря виходять з неї. За здатністю розчинятися у воді повітря на лежить до погано розчинних сумішей. Так, в 1 л води розчиняється 0,02918 л повітря. Але на віть такої невеликої кількості повітря достатньо для дихання риб, багатьох інших мешканців водойм. З підвищенням температури здатність повітря розчинятись у воді зменшується. Можна спостерігати, як з холодної води у прозорій вазі з квітами за кімнатної температури виділяються дрібні пухирці повітря й осідають на внутрішній поверхні посудини та рослинах.
У повітрі добре поширюється звук. Якби астронавти, що побували на Місяці, спробували звично поговорити між собою, у них би нічого не вийшло. Це тому, що на Місяці звук не поширюється через відсутність у супутника Землі повітряної оболонки.
Проте тепло у повітрі поширюється погано. Ось чому у вікнах вставляють подвійні, а в сучасних — навіть потрійні шибки. Розташоване між ними повітря допомагає зберігати тепло у приміщеннях. Невипадково на зиму у птахів густішає пір’я, а у звірів шерсть. Між їхніми ворсинками теж затримується повітря й зменшує тепловіддачу тіла.
Повітря піддається стисненню, тобто воно пружне. У цьому переконує дослід. Якщо наповнену повітрям кульку стиснути з боків, у місці стиснення з’явиться заглиблення. Як тільки припинити стиснення, кулька завдяки пружності повітря набуде попередньої форми.
Скарбничка ерудита
Ви вже знаєте, що у суміші кожний компонент зберігає свої властивості. Однією з властивостей повітря є різні температури переходу його компонентів з рідкого агрегатного стану у газоподібний і навпаки. На здатності повітря переходити при охолодженні з газоподібного стану у рідкий та різній температурі випаровування окремих його компонентів ґрунтується промислове добування азоту, кисню, аргону з рідкого повітря. Зі зрідженого повітря при його нагріванні спершу випаровується азот, а потім аргон. У
VІ. Закріплення знань.
Складання конспекту уроку
Хімічний елемент ___________
Формули простих речовин ________
Структурна формула кисню __________
Відносна молекулярна маса кисню ______
Знаходження в природі кисню_____
Склад повітря _____
Значення кисню_________
Структурна формула озону __________
Відносна молекулярна маса озону ______
Знаходження в природі озону_____
Значення озону_________
Фізичні властивості кисню та озону______
VІІ. Підсумок уроку.
VІІІ. Домашнє завдання.
Опрацювати §
Письм. № __________
Підготувати повідомлення:
- «Історія відкриття кисню»;
- «Склад повітря»;
- «Значення кисню в житті людини».

про публікацію авторської розробки
Додати розробку
