Конспект уроку з хімії для 8-го класу на тему: "Хімічні властивості кислот"
Урок-дослідження ,метою якого є ознайомити учнів із хімічними властивостями кислот; повторити техніку безпеки; розвивати основні операції мислення та пізнавальні процеси, вміння використовувати набуті знання у нестандартних ситуаціях; формувати вміння спостерігати, аналізувати перебіг реакцій.
Тема: Хімічні властивості кислот
Мета:
- навчальна: вивчити: а) дію кислот на індикатори; б) взаємодію з металами; в) взаємодію з основними оксидами; г) реакцію заміщення; відпрацювати вміння складати хімічні рівняння;
- розвиваюча: розвивати основні операції мислення та пізнавальні процеси, вміння використовувати набуті знання у нестандартних ситуаціях; формувати вміння спостерігати, аналізувати перебіг реакцій;
- виховна: виховувати почуття відповідальності, творчий підхід до навчання, здатності до дослідництва та експериментування; виховувати здоров’язбережувальні компетенції.
Тип уроку: урок засвоєння нових знань.
Форма проведення уроку: урок-дослідження.
Обладнання і реактиви: роздаткові матеріали до уроку, ноутбук, набір для практичних дослідів.
Засоби наочності: правила техніки безпеки під час роботи з кислотами.
Форми роботи: словесні, тренувальні вправи, інтерактивні вправи, наочні, практичні.
Методи роботи: індивідуальна, фронтальна.
Очікувані результати:
Учень:
- знає і дотримується правил безпечного поводження з кислотами в лабораторії та побутових умовах;
- розрізняє реакції, що характеризують хімічні властивості кислот від інших класів речовин; реакції заміщення;
- пояснює хімічні властивості кислот, особливості взаємодії кислот з металами;
- характеризує дію кислот на індикатори, взаємодію з металами, основними оксидами;
- практично виконує лабораторні досліди і пояснює їх;
- складає рівняння реакцій заміщення та обміну;
- вміє використовувати ряд активності металів під час складання рівнянь реакцій взаємодії кислот з металами.
Девіз уроку:«Дерево науки всім своїм корінням пов’язане з практикою»
О. Несмеянов
«Просто знати – ще не все, знання треба використовувати»
Й. Гете
Хід уроку
І Організаційний етап
Привітання учнів, перевірка готовності до уроку.
«Сьогодні у нас незвичайний урок, в нас присутні гості. Але як водиться в гарному домі, гості відпочивають, а господарі – працюють, то ж ми з вами почнемо працювати».
ІІ Актуалізація опорних знань та мотивація навчальної діяльності
Вчитель. Рік тому ви почали вивчати новий предмет – хімію. За цей період ми з вами вивчили хімічний алфавіт, навчилися складати хімічні рівняння, ознайомилися з деякими простими речовинами та їх властивостями. А тепер поглиблюємо свої знання з хімії, вивчаючи основні класи неорганічних сполук та їх властивості.
Тема уроку: Хімічні властивості кислот
Мета:вивчити: а) дію кислот на індикатори; б) взаємодію з металами; в) взаємодію з основними оксидами; г) реакцію заміщення.
Вчитель. Вам подобається подорожувати? Заняття проведемо у вигляді уроку-подорожі. Перш, ніж розпочати мандрівку, потрібно підготувати рюкзак та отримати паспорт. Тобто повторити основні поняття, які допоможуть вам подолати перешкоди. Отож вирушаємо.
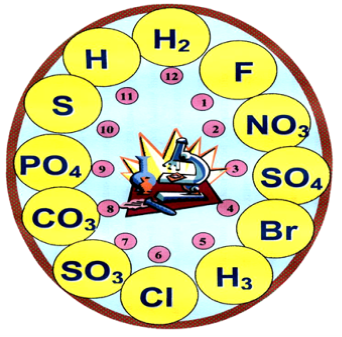
Вправа «Хімічний годинник»
Скласти формули кислот та назвати їх.
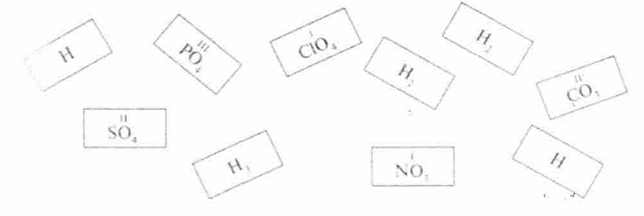
Вправа «Пасьянс»
На столи учні даються картки, необхідно скласти формули кислот.
Вправа «Хто зайвий?»
У кожному ряді знайдіть зайву кислоту та вкажіть за яким принципом ви це визначили.
1) H2S, H2CO3, H3PO4, H2SO4, H2SO3
2) HNO3, HCl, HBr, HI, HF
3) H2CO3, H2SO4, HNO3, H2SO3, H2SiO3
ІІІ Вивчення нового матеріалу
Вибираючи країну для подорожі, турист вивчає основні пам’ятки та місця для відвідування. Ми також проведемо огляд. І прямуємо до першої станції «Інформаційної».
Перша станція «Інформаційна»
1. Багато кислот містить наша їжа. Фрукти, овочі, молочні продукти, ліки постачають нам цілий букет кислот: яблучну, щавлеву, лимонну, молочну, оцтову. Навіть синильна кислота, щовважається отрутою, знайома кожному,хто розбивав кісточки слив і вишень. Кількість її у кісточці мізерна, але відчути запах гіркого мигдалю можна.
2.Якщо влітку підійти близько до мурашника, то можна надовго запам'ятати жалкі укуси його мешканців. Мурашки не лише кусають, вони вприскують у ранку мурашину кислоту. Цю ж мурашину кислоту містить кропива.
- Важливу роль відіграють кислоти в організмі людини. Фосфатна кислота у вигляді солей є основою кісток, зубів. Амінокислоти утворюють білок — основужиття. Хлоридна кислота входить до складу шлункового соку й допомагає перетравлювати їжу.
- Ось уже 1000 років, як люди навчились одержуватисульфатну кислоту. Алхіміки одержували її, прожарюючи купорос, звідси й назва сульфатної кислоти — купоросна олія, що застосовується і сьогоднідля 92%-ї сульфатної кислоти. Через важливість їїзастосування в усіх галузях народного господарствасульфатну кислоту називають «хлібом хімічної промисловості».
- Щорічно виробляють мільйони тонн нітратної кислоти. Найбільше її витрачається на виробництво мінеральних добрив, барвників, смол, пластмас. Одначастка нітратної кислоти та три частки хлоридноїкислоти відомі під назвою «царська горілка», в якій можна розчинити царя металів — золото.
6. Карбонатна кислота входить до складу природних мінеральних вод «Миргородська», «Трускавецька», «Боржомі» та ін. Нітратна та сульфітна кислоти можуть міститись у дощовій воді (так звані «кислотні дощі»).
7. Кислоти – їдкі речовини. Вони роз'їдають папір, деревину, тканини. Бризки кислоти, потрапляючи на шкіру, можуть спричинити хімічний опік. Тому поводитись із кислотами слід обережно.
Друга станція «Техніка безпеки»
Отримуючи візу для подорожі за кордон, мандрівнику пропонують застрахувати своє життя. Вивчення хімії неможливе без дотримання правил техніки безпеки.Перед вами кросворд, ваше завдання – відповісти на мої запитання.
|
Н |
Е |
|
|
|
|||||||||
|
Н |
Е |
|
|
|
|
||||||||
|
Н |
Е |
|
|
|
|
|
|
|
|||||
|
Н |
Е |
|
|
|
|
|
|
|
|
|
|||
|
Н |
Е |
|
|
|
|
|
|
|
|
|
|||
|
Н |
Е |
|
|
|
|
|
|
НА |
|
|
|
|
|
1. Заборона на харчування в лабораторії(не ЇЖ)
2. Заборона на вживання рідини в лабораторії(не ПИЙ)
3. Заборона – вказівка до дій із залишками речовин(не ЗЛИВАЙ)
4. Заборона знаходження над посудом, в якому відбуваються перетворення речовин(не НАХИЛЯЙСЯ)
5. Не будь надто цікавим – не(вставити слово)у посудину з реагентами(не ЗАГЛЯДАЙ)
6. Для визначення смакових якостей реагентів ніколи не(не ПРОБУЙ)
Учні називають правила техніки безпеки під час роботи з кислотами.
- Під час роботи з кислотами слід бути обережним.Особливо слід берегти очі. У разі потрапляння кислоти на руки необхідно негайно змити її великоюкількістю води.
- Уважно читайте етикетку на банці з речовиною, якуберете для досліду.
- Відкривши банку, не кладіть пробку на лабораторнийстіл, а поставте її.
- Наливаючи рідини, посудину з реактивом беріть так,щоб етикетка була направлена в бік долоні, знімайтекраплю з краю шийки, інакше рідина стікатиме посклу та псуватиме етикетку; може пошкодити шкірурук.
- Посудину, з якої взяли реактив, відразу ж закрийтета поставте на місце.
Проблемне питання:
- Чому досвідчені господарки, готуючи борщ або страви з буряка, обов'язково додають сік лимону або оцет.
Третя станція «Індикаторна»
- Які речовини називають індикаторами?
- Назвіть основні види індикаторів.
Дослід 1. Дія кислот на індикатори
- Налийте по 1—2 мл кислоти в три порожні пробірки.Додайте в кожну по одній краплі індикатора:лакмуса, фенолфталеїну, метилоранжу.
- Спостерігайте, як змінюється забарвлення індикаторів у кислоті. Спостереження запишіть у таблицю.
|
Формула речовини |
Метилоранж |
Лакмус |
Фенолфталеїн |
Універсальний індикатор |
|
НСl |
|
|
|
|
Висновок. Кислоти змінюють забарвлення:синього лакмусу на_____________ оранжевого метилоранжу на_____________. Забарвлення в кислоті не змінює індикатор_________________.
Фізкультхвилинка:
Якщо я піднімаю формулу кислоти – ви піднімаєте праву руку;
якщо я піднімаю формулу оксиду – ви піднімаєте ліву руку;
якщо я піднімаю формулу основи – ви торкаєтесь носа;
якщо я піднімаю формулу солі – ви торкаєтесь вуха.
Четверта станція «Металева»
Проблемне питання:
- Чому кисломолочні продукти, квашену капусту, кислі соки не рекомендується зберігати в алюмінієвому посуді?
Вчитель. Чи з усіма металами реагують кислоти?
Дослід 2. Взаємодія кислот з металами
У кожну пробірку з різними металами додайте 2—3 мл розчину кислоти.
Результати спостережень зафіксуйте в таблиці з допомогою знаку «+».
|
Метал |
Кислота |
Бурхливе виділення газу |
Рівномірне виділення газу |
Газ не виділяється |
|
Zn |
|
|
|
|
|
Fe |
|
|
|
|
|
Mg |
|
|
|
|
|
Cu |
|
|
|
|
Вчитель робить запис на дошці:
метал + кислота = сіль + водень
Більшість відомих вам кислот реагує з металами з виділенням водню і утворенням солей. Серед них – усі безоксигенові кислоти, сульфатна(у розбавленому розчині).
Під час таких реакцій атоми металічного елемента, які містяться в простій речовині, заміщують атоми іншого елемента (Гідрогену) у складній речовині. Такі реакції називають реакціями заміщення. Як видно із досліду, з кислотами взаємодіють не всі кислоти. Передбачити можливість реакції між металом і кислотою можна за допомогоюряду активності металів. Його склав у 1865 р. вітчизняний хімік
М.М. Бекетов на підставі вивчення реакцій металів із кислотами і солями. Формула неметалу водню поділяє ряд на дві частини. Метали, розміщені в його лівій частині, взаємодіють із названими кислотами(при цьому виділяється водень), а розміщені праворуч – не реагують з ними.
Висновок: Не всі метали реагують з розчинами кислот, а ті, що реагують, – реагують по-різному, це залежить від___________________________ металів.
Проблемне питання:
- А як же одержати солі металів, які стоять у ряду Бекетова після водню?
Для розв'язання цієї проблеми робимо зупинку на станції «Оксидна».
П'ята станція «Оксидна»
Демонстрація досліду взаємодії купрум(ІІ) оксиду із сульфатною кислотою.
Насипаємо у пробірку купрум(ІІ) оксиду і додаємо краплямисульфатну кислоту. Що спостерігаємо? Запишемо рівняння реакції. Укажіть тип реакції.
CuO+H2SO4=CuSO4 +H2O
Спостерігаємо утворення зеленкувато-блакитного розчину. Реакція належить до реакцій обміну.
IV Практичне застосування набутих знань
Конфуцій говорив, що добре мати природний дар, але тренувальні вправи дають більше. Тому перевіримо ваші практичні навички та вміння в ході гри «Сапер»
Гра «Сапер»
Закресліть ті реакції, у результаті яких утворюється водень.
Правильність відповіді підтвердьте складанням рівнянь реакцій.
|
H2SO4 + Fe(OH)3 |
|
HCl + CaCO3 |
|
NaHSO3 + H2SO4 |
|
|
Zn + H3PO4 |
|
Fe + H2SO4 (розб.) |
|
Ca + HCl |
|
|
Al (OH)3 + HCl |
|
Cu + H2SO4 |
|
Fe + HCl |
|
|
Cu+ HCl |
|
HNO3 + NaOH |
|
Na2O + HCl |
|
|
Ca + HCl |
|
Na2CO3 + HCl |
|
Ag + H3PO4 |
|
|
Zn + H2SO4 |
|
Ba + H2SO4 |
|
Al2O3 + HCl |
|
Гра «Сторінка із щоденника»
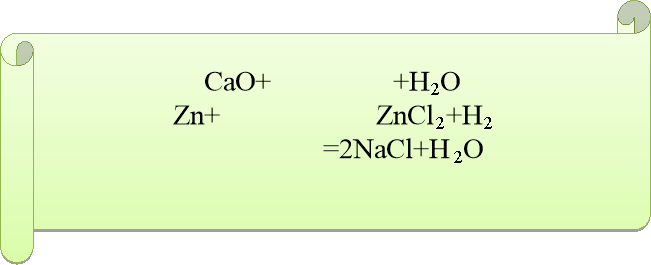 Вам потрібно відновити втрачену інформацію із сторінки щоденника члена команди мандрівників
Вам потрібно відновити втрачену інформацію із сторінки щоденника члена команди мандрівників

Гра «Знайди помилку»

V Рефлексія
1. Які знання та вміння ви вдосконалили, а які отримали вперше?
2. Що було найцікавішим на уроці?
3. Чи зможете ви використати знання, отримані на уроці, якщо подальше життя не пов’яжете з хімією?
VI Домашнє завдання
Дякую всім учасникам подорожі. Ви були активними мандрівниками і компетентними дослідниками, толерантними співбесідниками. Сподіваюся, що знання, вміння, отримані сьогодні на уроці знадобляться вам в житті.
Кожен мандрівник, повертаючись з подорожі, переглядає домашню пошту. Такою поштою для вас стане домашнє завдання у конвертах.
Дякую за увагу!
Додаток: Маршрутний лист
_____________________________ «___»___________ 20__ р.
Маршрутний лист
Кросворд«Правила технікибезпеки»
|
Н |
Е |
|
|
|
|||||||||
|
Н |
Е |
|
|
|
|
||||||||
|
Н |
Е |
|
|
|
|
|
|
|
|||||
|
Н |
Е |
|
|
|
|
|
|
|
|
|
|||
|
Н |
Е |
|
|
|
|
|
|
|
|
|
|||
|
Н |
Е |
|
|
|
|
|
|
НА |
|
|
|
|
|
Правила техніки безпеки під час роботи з кислотами.
- Під час роботи з кислотами слід бути обережним.Особливо слід берегти очі. У разі потрапляння кислоти на руки необхідно негайно змити її великоюкількістю води.
- Уважно читайте етикетку на банці з речовиною, якуберете для досліду.
- Відкривши банку, не кладіть пробку на лабораторнийстіл, а поставте її.
- Наливаючи рідини, посудину з реактивом беріть так,щоб етикетка була направлена в бік долоні, знімайтекраплю з краю шийки, інакше рідина стікатиме посклу та псуватиме етикетку; може пошкодити шкірурук.
- Посудину, з якої взяли реактив, відразу ж закрийтета поставте на місце.
Дослід 1. Дія кислот на індикатори
- Налийте по 1—2 мл кислоти в три порожні пробірки. Додайте в кожну по одній краплі індикатора:лакмуса, фенолфталеїну, метилоранжу.
- Спостерігайте, як змінюється забарвлення індикаторів у кислоті. Спостереження запишіть у таблицю.
|
Формула речовини |
Метилоранж |
Лакмус |
Фенолфталеїн |
Універсальний індикатор(папірець) |
|
|
|
|
|
|
Висновок. Кислоти змінюють забарвлення:синього лакмусу на_____________ оранжевого метилоранжу на_____________. Забарвлення в кислоті не змінює індикатор_________________.
Фізкультхвилинка:
Якщо я піднімаю формулу кислоти – ви піднімаєте праву руку;
якщо я піднімаю формулу оксиду – ви піднімаєте ліву руку;
якщо я піднімаю формулу основи – ви торкаєтесь носа;
якщо я піднімаю формулу солі – ви торкаєтесь вуха.
Дослід 2. Взаємодія кислот з металами
У кожну пробірку з різними металами додайте 2—3 мл розчину кислоти.
Результати спостережень зафіксуйте в таблиці з допомогою знаку «+».
|
Метал |
Кислота |
Бурхливе виділення газу |
Рівномірне виділення газу |
Газ не виділяється |
|
Zn |
|
|
|
|
|
Fe |
|
|
|
|
|
Mg |
|
|
|
|
|
Cu |
|
|
|
|
Висновок: Не всі метали реагують з розчинами кислот, а ті, що реагують – реагують по-різному, це залежить від___________________________ металів.


про публікацію авторської розробки
Додати розробку
