Презентація «Хімічні властивості оксидів» 8 клас
| Презентація допоможе в проведенні уроку на тему: «Хімічні властивості оснόвних, кислотних та амфотерних оксидів: взаємодія з водою, кислотами, лугами, іншими оксидами». Презентація потребує доповнення відеофрагментами реакцій. |


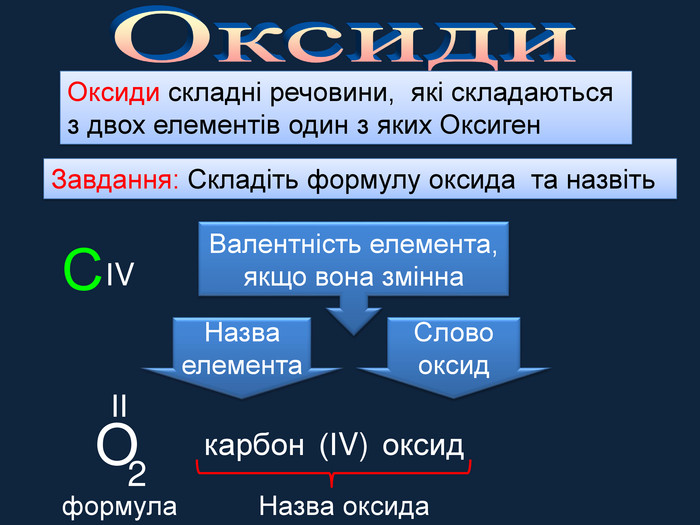
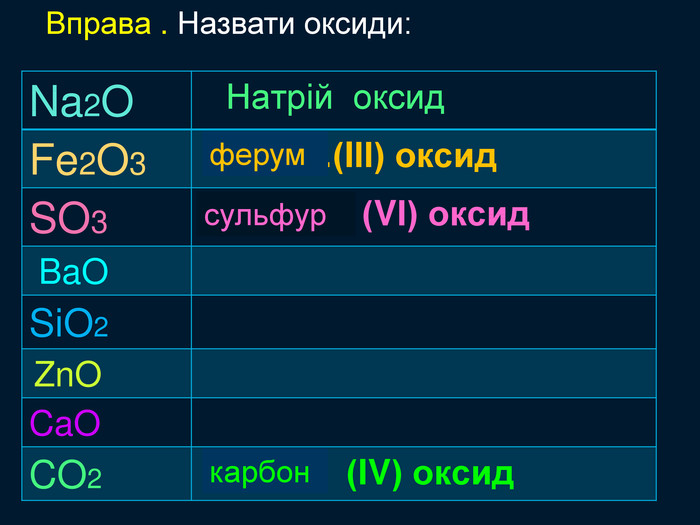


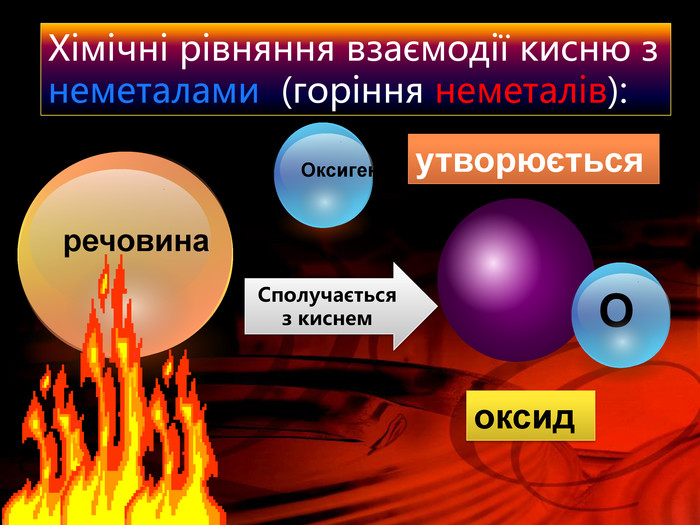


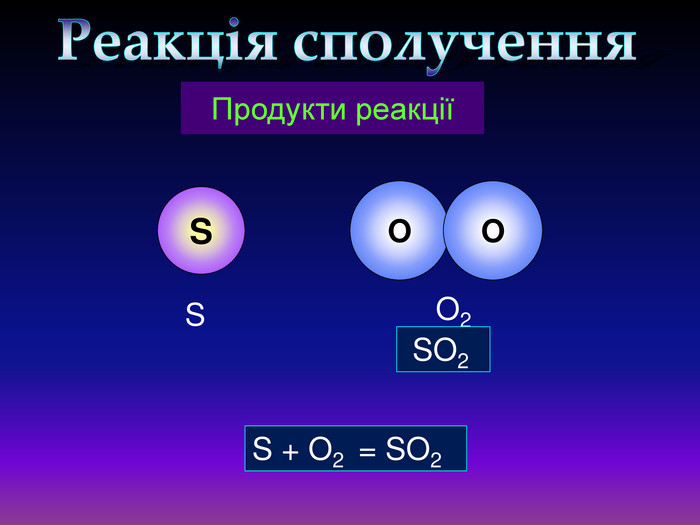












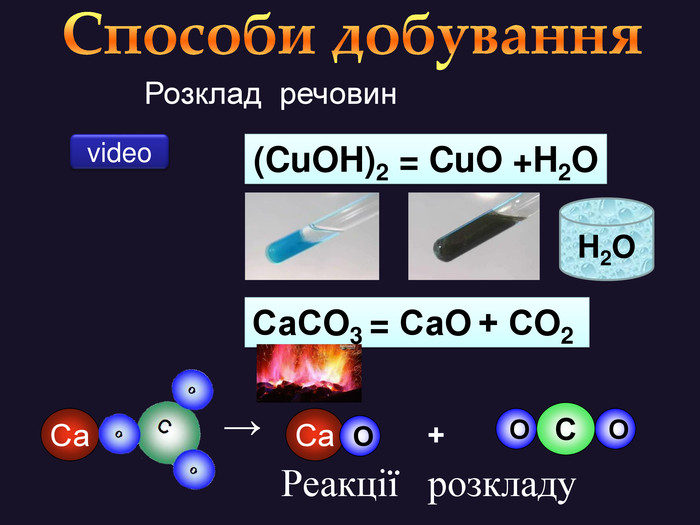
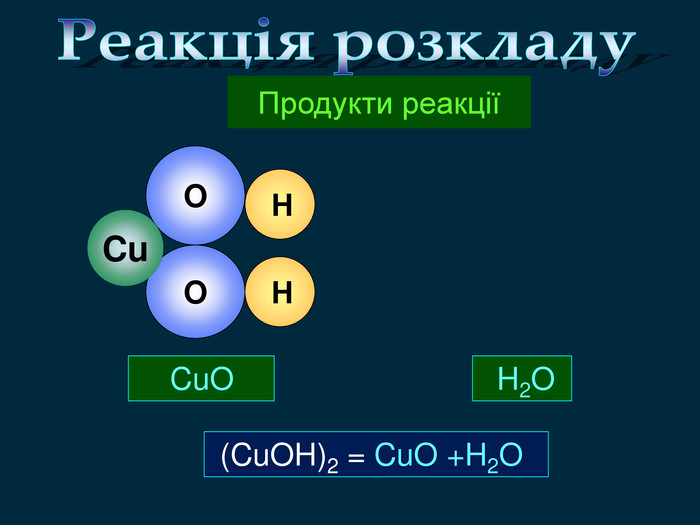






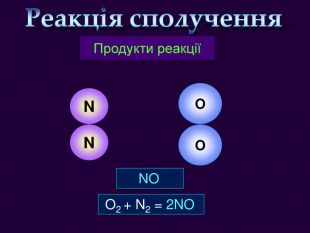
Кисень — один з найактивніших неметалів. Він взаємодіє з більшістю неметалів і металів. Як правило, реакції протікають при нагріванні і супроводжуються виділенням теплоти та світла. Хімічну реакцію, під час якої виділяється теплота і з'являється полум'я, називають горінням.video. С + O2 = СO2
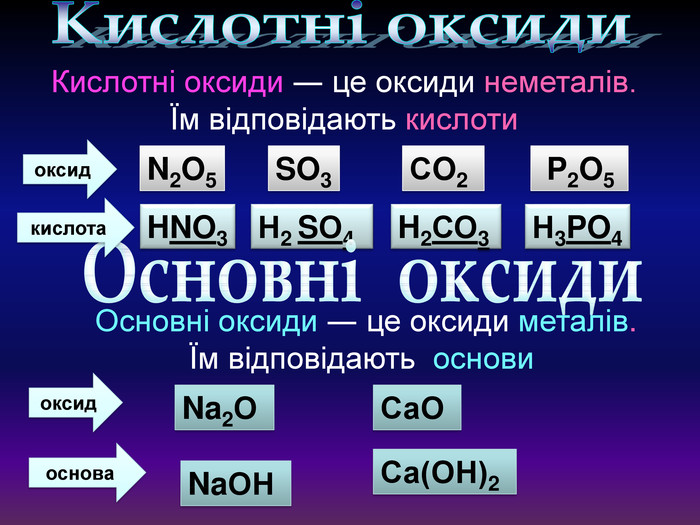
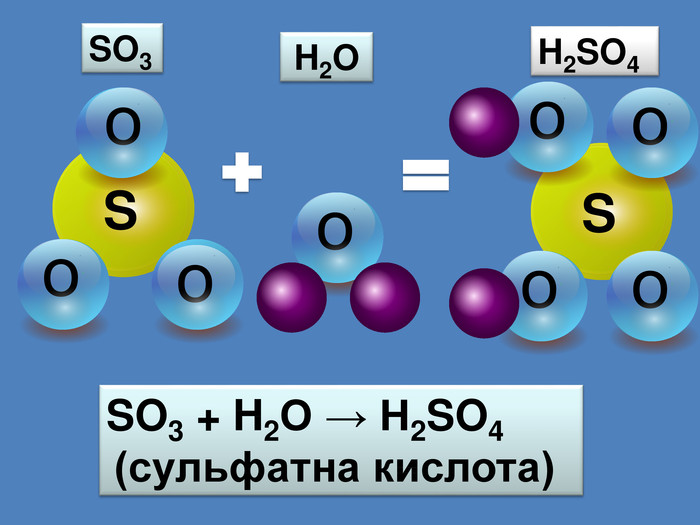
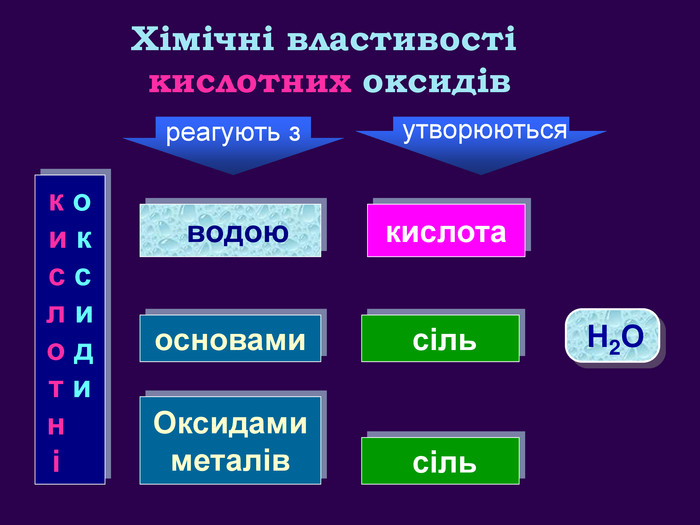
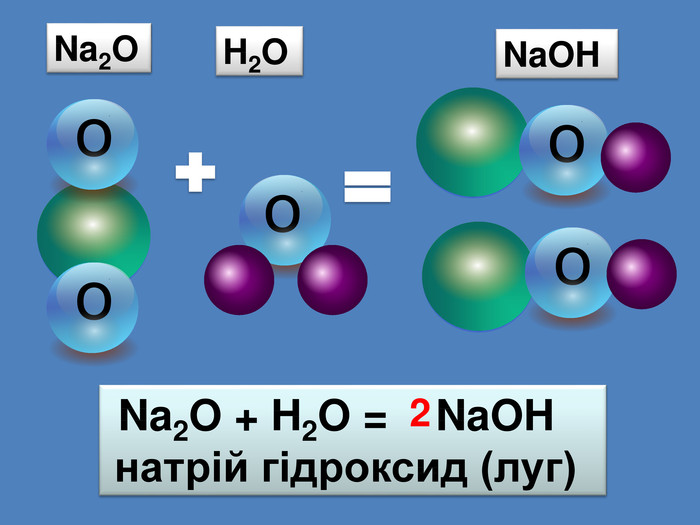
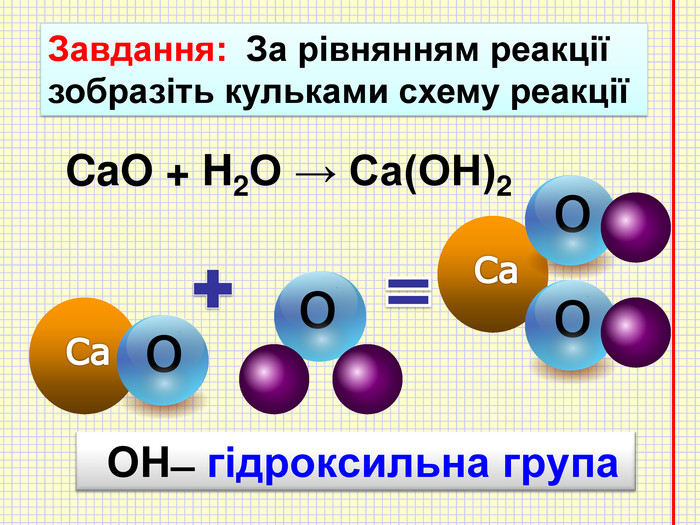
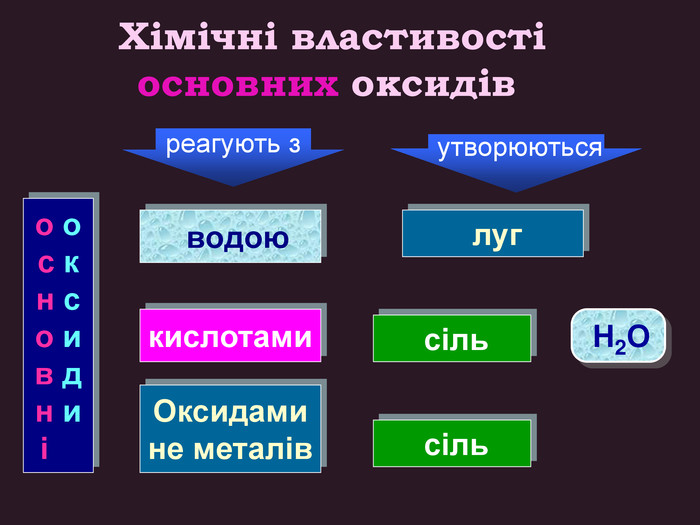
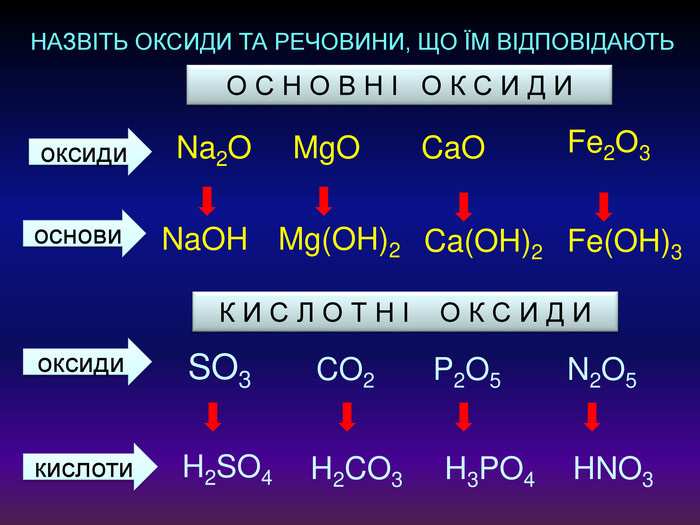
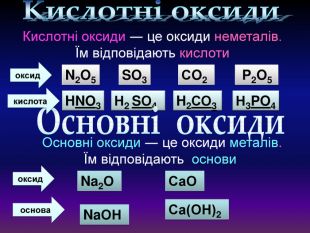
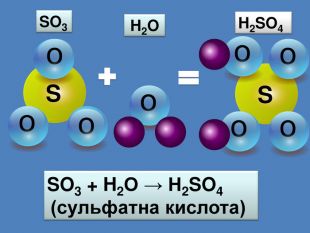
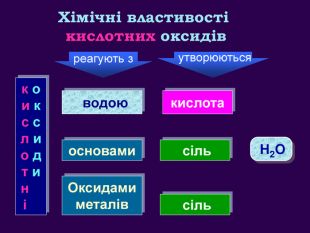
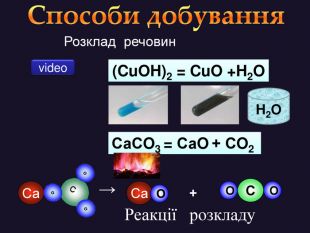
Кислотні оксиди взаємодіють з основами (лугами) утворюють сіль та воду. Кислотний оксид + луг = сіль + вода. Са(OН)2 + СO2 → Са. СО3 ↓ + Н2 OОксиди, які взаємодіють з основами й утворюють сіль та воду називають кислотними оксидами Зверніть увагу! В реакцію вступають тільки розчинні у воді основи 2 Na. OH + СO2 → Na2 CO3 + H2 O 6 KOH + P2 O5 → 2 K3 PO4 + 3 H2 O video
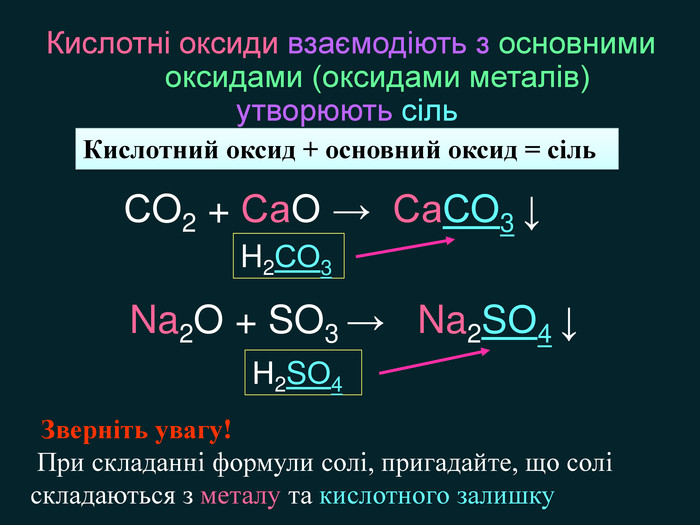
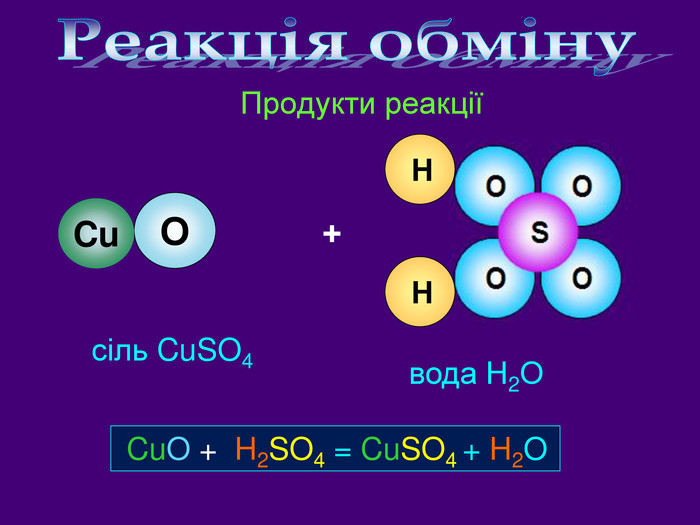
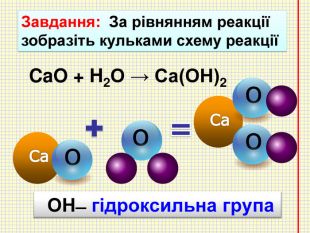
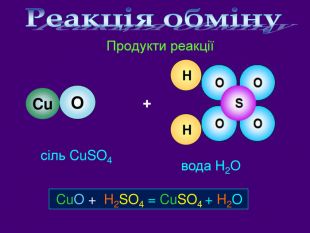
Кислотні оксиди взаємодіють з основними оксидами (оксидами металів) утворюють сіль Кислотний оксид + основний оксид = сіль СO2 + Са. O → Са. СО3 ↓ Na2 O + SO3 → Na2 SО4 ↓ Зверніть увагу! При складанні формули солі, пригадайте, що солі складаються з металу та кислотного залишку. H2 СО3 Н2 SО4
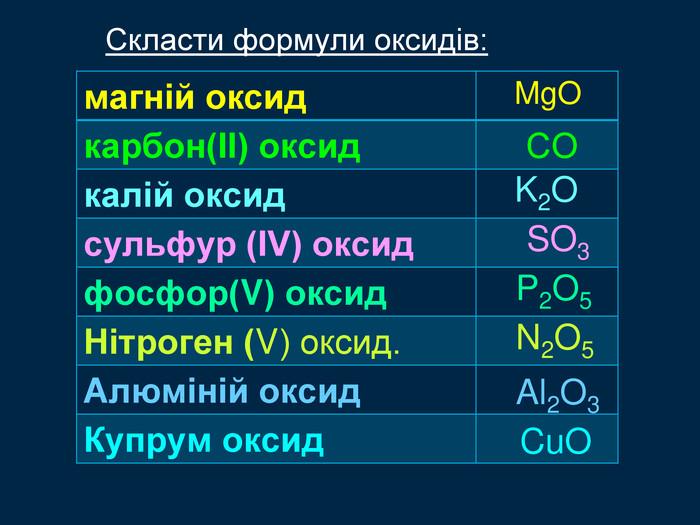
Амфотерні оксиди. Оксиди, які взаємодіють з кислотами й основами (лугами) утворюють сіль та воду називають амфотерними оксидами. Амфотерний з грецької означає і той, і інший; обидва До них належать: берилій оксид Be. O, цинк оксид Zn. O, алюміній оксид Al2 O3, плюмбум оксид Pb. O, хром (ІІІ) оксид Cr2 O3 Їм відповідають гідрати берилій гідрооксид Be(OН)2, цинк гідроксид Zn(OН)2, алюміній гідрооксид Al(OН)3, плюмбум гідрооксид Pb(OН)2, хром (ІІІ) гідрооксид Cr(OН)3
Григорович О. В. Хімія.8 клас: Розробки уроків —Х.: Вид-во “Ранок”, 2008. Ярошенко О. Г. Хімія: підруч. для 8 кл. загальноосвіт. навч. закл. Освіта, 2008. Шаповалов С. А. Довідник старшокласниката абітурієнта. Х. Торсінг, 2005. Хімія. 8 клас І. Ю. Старовойтова, О. В. Люсай. — X. : Вид. група «Основа», 2009. — 128 с. — (Серія «Мій конспект»). Джерела


про публікацію авторської розробки
Додати розробку
















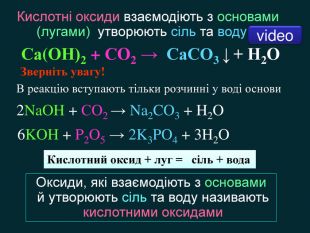


















-

Бурда Тетяна Валеріївна
11.03.2024 в 23:39
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Задорожна Ніна Олександрівна
08.03.2023 в 13:22
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Купріян Елеонора
19.02.2023 в 13:26
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Данілова Діана
15.02.2023 в 18:57
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Плодієнко Ольга Миколаївна
06.10.2022 в 20:53
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Підкалюк Любов Петрівна
24.02.2022 в 08:30
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

фертак наталя
20.02.2022 в 12:28
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Мельничук Альона Сергіївна
13.02.2022 в 15:21
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Нікітенко Наталія Володимирівна
19.01.2022 в 20:04
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Токарчук Тетяна Василівна
08.02.2021 в 22:02
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Егорова Оксана Анатоліївна
02.04.2020 в 21:44
Ваші презентації чудові! Сил Вам та натхнення!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Пишна Марина Юліївна
20.03.2020 в 11:31
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Моренко Александр
16.02.2020 в 23:22
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Паращак Наталія Миколаївна
04.12.2019 в 11:31
Дякую за корисний матеріал!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Теребіленко Людмила Володимирівна
19.01.2019 в 19:48
Дякую за класну презентацію. Буду використовувати на уроках
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Корець Тетяна
20.02.2018 в 22:07
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 13 відгуків