Хімічні диктанти для 8 класу
Хімічні диктанти для 8 класу розроблені у вигляді графічних диктантів, формульних диктантів та цифрових диктантів по різним темам, які сприяють перевірці знань учнів нетрадиційним шляхом та допомагають урізноманітнювати способи і методи контролю знань учнів.
Графічні диктанти (8 клас)
(![]() - так, V- ні)
- так, V- ні)
Тема: Хімічні властивості лугів і нерозчинних основ.
- Гідроксиди лужних металів належать до нерозчинних основ.
- Луги – це розчинні у воді основи.
- Розчини лугів роз’їдають шкіру, тканини та інші матеріали.
- Нерозчинні основи змінюють забарвлення фенолфталеїну на малиновий колір.
- Нерозчинні основи милкі на дотик, дуже їдкі.
- Нерозчинні основи взаємодіють з основними оксидами при нагріванні.
- Розчини лугів змінюють забарвлення індикаторів.
- Розчини лугів взаємодіють з розчинами солей, якщо новоутворена сіль або основа випадає в осад.
- Розчини лугів змінюють забарвлення індикатора метилоранжу з оранжевого на рожевий.
- Розчини лугів взаємодіють з розчинами кислот, утворюючи сіль і воду. Ця реакція називається реакцією нейтралізації.
- Нерозчинні основи при нагріванні розкладаються з утворенням оксиду металу і води.
- Нерозчинні основи - тверді речовини, що мають різне забарвлення.
Відповіді:
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
|
V |
|
|
V |
V |
V |
|
|
V |
|
|
|
|
Тема: Хімічний зв’язок. Будова речовин.
- Хімічний зв’язок – це взаємодія атомів (чи будь-яких інших частинок у речовині), яка зумовлює їх сполучення у молекули та кристали.
- В утворені хімічного зв’язку беруть участь кулонівські сили, носіями яких є електрони і ядра атомів.
- У простих речовинах неметалів існує полярний ковалентний зв‘язок.
- Ковалентний зв’язок під час якого відбувається зміщення електронних пар до більш електронегативного атома називаються неполярним ковалентним зв’язком.
- Донорно – акцепторний зв‘язок має ще назву - координаційний.
- Водневий зв’язок це один із різновидів ковалентного зв’язку.
- Диполь – це система з двох зарядів, однакових за величиною і протилежним за знаком.
- Метали проводять електричний струм, тому що їм характерний йонний зв‘язок.
- Йонний зв’язок характерний сполукам металів з неметалами.
- Між атомами неметалів з різною електронегативністю виникає неполярний ковалентний зв’язок.
- Речовини, що мають йонні кристалічні решітки легкоплавкі і крихкі.
- Алмаз – надзвичайно тверда природна сполука, тому що має йонну кристалічну решітку.
Відповіді:
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
|
|
|
V |
V |
|
|
|
V |
|
V |
V |
V |
|
Тема: Валентність і ступінь окиснення.
- Валентність і ступінь окиснення це рівнозначні поняття.
- Валентність - це умовний заряд атома.
- Ступінь окиснення атома вказує на кількість електронів, які зміщуються до більш електронегативного елемента.
- Гідроген завжди має ступінь окиснення в сполуках -1.
- Ступінь окиснення Оксигену в сполуках в основному дорівнює -2.
- Метали завжди мають позитивну ступінь окиснення в сполуках.
- Алгебраїчна сума позитивних і негативних ступенів окиснення елементів у сполуках дорівнює нулю.
- Флуор в сполуках завжди має ступінь окиснення +1.
- Лужні метали мають ступінь окиснення у сполуках +1.
- Ступінь окиснення Гідрогену в гідридах дорівнює -1.
- Неметали завжди мають негативну ступінь окиснення в сполуках з металами.
- Ступінь окиснення елементів в простих сполуках дорівнює -2.
Відповіді:
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
|
V |
V |
|
V |
|
|
|
V |
|
V |
|
V |
|

-
За якою формулою визначають кількість молекул газу у відомому об‘ємі даного газу. (
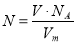 ).
).
- Стала Авогадро чисельно дорівнює (6,02·1023 моль-1).
-
За якою формулою визначають об’єм газу (при нормальних умовах), якщо відома маса даного газу ?
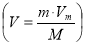 .
.
-
За якою формулою визначають густину речовини ? (
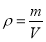 ).
).
-
За якими формулами можна визначити відносну густину газів ?
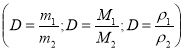 .
.
Тема: Солі, їх склад, назви, визначення, значення.
- Яка група солей утворена атомами металів і кислотних залишків? Наведіть формули двох солей, що належать до цієї групи. (Середні, Na2CO3; Ba(NO3)2).
- Написати формулу кальцій гідроген карбонату. (Ca(HCO3)2).
- Солі, які містять у своєму складі крім металів і кислотного залишку одну або декілька гідроксогруп називаються … .Наведіть формулу однієї з таких солей. (Основними, CuOHNO3).
- При взаємодії амфотерних оксидів і гідроксидів утворюються солі, які належать до … . Наведіть приклад формули однієї з таких солей. (Подвійними, K2ZnO2).
- Напишіть формулу хром (III) сульфату. До яких солей належить дана сіль? (Cr2(SO4)3 , середніх).
- Напишіть формулу ферум (III) дигідроксибромід. (Fe(OH)2Br).
- Напишіть формулу берилату натрію. (Na2BeO2).
Тема: Узагальнення знань про основні класи неорганічних сполук, генетичний зв‘язок.
- Який клас неорганічних сполук поділяють на дві групи за нерозчинністю? (Основи).
- Розчини яких речовин змінюють забарвлення метилоранжу на рожевий? (Кислоти).
- Які речовини при нагріванні розкладаються на оксид металу і воду? (Нерозчинні основи).
- При взаємодії кислотних оксидів з лугами утворюється вода і …(Солі).
- Речовини, розчини яких милкі на дотик і роз’їдають шкіру називаються … (Луги).
- Оксиди, які при взаємодії з кислотами утворюють сіль і воду називаються … (Основні оксиди).
- Розчини яких речовин змінюють забарвлення фенолфталеїну на малиновий ? (Луги).
- Як називаються оксиди, які за різних умов одночасно взаємодіють з кислотами і лугами ? (Амфотерні)
- Речовини якого класу поділяють на дві групи: безоксигенові і оксигеновмісні? (Кислоти)
- Які речовини одержують при дії води на оксиди активних металів? (Луги).
- Про основність яких речовин вивчають в курсі хімії ? (Кислоти)
- Які речовини утворюються в результаті взаємодії основних і кислотних оксидів ? (Солі).
Тема: Характеристика хімічних елементів за положенням у ПС та будовою атома.
- Напишіть формулу простої сполуки елемента, що має таку електронну формулу: 1s22s22p63s23p5 .(Cl2).
- Вкажіть елемент та які він має властивості: металеві чи неметалеві, якщо електронна формула атома його має таке закінчення: …4s24p5 (Br - бром, неметал).
- Назвіть елемент і вкажіть які властивості: металеві чи неметалеві він має, якщо в ядрі атома цього елемента 30 протонів. (Zn - цинк, метал).
- Вкажіть елемент та формулу вищого оксиду, якщо навколо ядра в атомі цього елемента рухається 16 електронів. (S - сульфур, SO3).
- Яка формула леткої водневої сполуки елемента, ядро атома якого складається з 14 протонів і такої ж кількості нейтронів? (SiH4).
- Атом якого елемента має однакову з йоном алюмінію будову електронної оболонки? Назвіть елемент. Відповідь підтвердить записом електронної формули його атома. (Ne - неон; 1s22s22p2).
- Напишіть формулу оксида елемента, електронна формулу атомів якого має таке закінчення: …3s23p1. (Al2O3).
- Вкажіть елемент і запишіть формулу його вищого оксиду, якщо відомо, що він знаходиться в четвертому періоді і в побічній підгрупі п‘ятої групи. (V - ванадій; V2O5).
-
Визначте скільки нейтронів містить міститься у ядрі атома елемента з порядковим номером 27. (Co - кобальт,
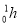 - 32).
- 32).
- Напишіть загальну формулу вищого оксиду елементів головної підгрупи, у яких на зовнішньому енергетичному рівні по 7 електронів. (R2O7).
- Напишіть формулу сполуки, яка утвориться при взаємодії простих речовин , утворених елементами, електронні формули атомів яких мають таке закінчення: …3d104s1 і …3s23p4. (K2S- калій сульфід).
- Атом має на 2 електрони більше, ніж йон калію. Назвіть елемент, напишіть формулу його хлориду. (Ca - кальцій; CaCl2).
Цифрові диктанти (8 клас)
Тема: Хлоридна кислота: властивості, добування, застосування.
- Яка формула хлоридної кислоти?
- Яку ще назву має дана кислота?
- Взаємодією кухонної солі з якою кислотою добувають хлороводневі кислоту в лабораторії?
- З якими з перерахованих складних речовин буде взаємодіяти хлоридна кислота?
- З якими з зазначених металів не буде взаємодіяти розчин хлоридної кислоти?
- Яка речовина є якісним реактивом на хлоридну кислоту?
- Які речовини, що змінюють своє забарвлення під дією розчину хлоридної кислоти?
- Які спеціальні речовини захищають метали від руйнування у кислоті?
- З яким з перерахованих металів буде взаємодіяти розчин хлоридної кислоти?
I варіант
- AgNO3.
- H2SO4.
- Al.
- Індикатори.
- HCl.
- K2SiO3.
- Соляна.
- Cu.
- Інгібітори.
- CaO.
- Ag.
- Mg(OH)2.
II варіант
- K2SiO3.
- Індикатори.
- Mg(OH)2.
- Al.
- CaO.
- HCl.
- H2SO4.
- Ag.
- Соляна.
- Інгібітори.
- AgNO3.
- Cu.
Відповіді: I варіант
- 5.
- 7.
- 2.
- 1, 6, 10, 12.
- 8, 11.
- 1.
- 4.
- 9.
- 3.
II варіант
- 6.
- 9.
- 7.
- 1, 3, 5, 11.
- 8, 12.
- 11.
- 2.
- 10.
Тема: Поняття про радіоактивність і будову атомів. Склад атомних ядер. Ізотопи.
- Яке число дорівнює заряду ядра атома елементів?
- Тип атомів, що характеризуються однаковим протонним числом – це … .
- На які дві групи поділяють ізотопи?
- Різновиди атомів певного елемента, які мають однакове протонне число, але різне нуклонне число мас називаються … .
- Яка частина ядра атома має позитивний заряд?
- Тип атомів із певними значеннями нуклонного і протонного чисел називають … .
- Нукліди всіх елементів, розміщених у періодичній системі після Вісмуту впливають шкідливо на здоров‘я людини, тому що вони … .
- Нукліди одного хімічного елемента називають … .
- Яка частинка ядра атома не має заряду?
- Загальне число протонів і нейтронів в атомі елемента називають … .
- Яка елементарна частина атома весь час перебуває в русі?
- Елементи, які мають однакове нуклонне число, але різне протонне число, називаються … .
I варіант
- Протон.
- Ізобари.
- Стабільні.
- Нейтрон.
- Ізотопи.
- Хімічний елемент.
- Нуклонне число.
- Радіоактивні.
- Нуклід.
- Електрон.
- Протонне число.
II варіант
- Ізотопи.
- Нуклонне число.
- Нуклід.
- Ізобари.
- Протонне число.
- Радіоактивні.
- Нейтрон.
- Стабільні.
- Електрон.
- Протон
- Хімічний елемент.
Відповіді: I варіант
- 11.
- 6.
- 3, 8.
- 5.
- 1.
- 9.
- 8.
- 5.
- 4.
- 7.
- 10.
- 2.
II варіант
- 5.
- 11.
- 6, 8.
- 1.
- 10.
- 3.
- 6.
- 1.
- 7.
- 2.
- 9.
- 4.


про публікацію авторської розробки
Додати розробку
