Конспект уроку з хімії для 9 класу на тему "Етен і етин як представники ненасичених вуглеводнів.Молекулярні, електронні та структурні формули.Фізичні властивості".
Запропонований конспект уроку, призначений для надання допомоги вчителям у підготовці та проведенні уроків хімії у 9 класі 11 – річної школи та складений відповідно до чинної програми з хімії 11 – річної школи для загальноосвітніх навчальних закладів. Він має за мету зорієнтувати вчителів хімії у виборі педагогічних технологій для реалізації компетентнісного підходу до навчання та розвитку креативного мислення учнів.
Дата ______Клас _____ Вчитель: Дерев’янко Л.В.
Урок №36
Тема . Етен (етилен) і етин (ацетилен) як представники ненасичених вуглеводнів. Молекулярні, електронні та структурні формули. Фізичні властивості.
Цілі уроку:
Освітні: формувати знання учнів про гомологічні ряди алкенів та алкінів на прикладі етилену та ацетилену; ознайомити учнів із природою кратного зв’язку; навчити виводити загальну формулу алкенів та алкінів, знати їх фізичні властивості.
Розвиваючі : удосконалювати навички й уміння складати структурні формули й давати назви органічним сполукам на прикладі алкенів та алкінів; продовжувати розкривати значення методу моделювання для визначення будови й властивостей речовин; відпрацювати навички рішення задач на обчислення відносної густини газів.
Виховні: виховувати бажання вчитися активно, з цікавістю, формувати вміння креативно мислити, працювати у співпраці.
Тип уроку: комбінований урок засвоєння знань, умінь і навичок та творчого застосування їх на практиці.
Форма проведення : урок-дослідження.
Форми роботи: гра „Я маю про це поняття”, розв’язування кросвордів , розв’язування задач, самоперевірка; «Мозковий штурм», самостійна робота з
ПМК, складання порівняльної таблиці
Обладнання: кулестержневі моделі, порівняльна характеристика алканів та алкенів, картки самоперевірки до розв’язування задач, кросворди «Етен» і«Етин»
ХІД УРОКУ
I. Організація класу.
II. Перевірка домашнього завдання.
III. Актуалізація опорних знань.
Учитель. Діти, ви знайомі з багатьма таємницями дивної країни Хімія, але завжди залишається щось нерозгадане. І сьогодні ми постараємося здобути нові знання - розкрити одну з таємниць шляхом самостійної творчої роботи. Девізом уроку візьмемо слова Д. І. Менделєєва: «Самі працюючи, ви багато зробите для себе і для близьких, а якщо при праці успіху не буде, буде невдача, не біда - пробуйте ще».
Отже, в путь за таємницею. Щоб пізнати нове, потрібно згадати те, що вам вже відоме.
Давайте пограємо у гру „ Я маю про це поняття”
Правила гри прості я починаю речення, а ви його закінчуєте і отримуєте жетон, що коштує 0,5 бали.
1.Елемент, що лежить в основі будови всіх органічних сполук…(Карбон) 2.Атоми Гідрогену, Оксиґену,Нітрогену, Сульфуру, Фосфору в органічній хімії називають....(Елементами-органогенами)
3.Валентність Карбону в органічних сполуках...(Чотири)
4.Якісний склад вуглеводнів... (Карбон і Гідроген)
5.Найпростіша органічна сполука (Метан)
6. Гомологічний ряд – це ... (Ряд органічних сполук, які мають подібні за будовою молекули,що відрізняються за складом на одну або кілька груп атомів СН2)
7.Група атомів СН2 називається...(Гомологічною різницею)
8.Представником якого гомологічного ряду є метан...(Алканів)
9.Загальна формула алканів...(СnH2n+2 )
10.Тип гібридизації атомів Карбону в алканах...(sp3)
А тепер розгадаємо за варіантами невеличкі кросворди, ключовими словами яких будуть назви речовин, які сьогодні почнемо вивчати. Бажаю успіху.
Кожне відгадане слово – 1 бал.
Кросворд „Етен”
|
1. |
|
|
|
|
|
|
|
|
||||
|
|
|
3. |
|
4. |
|
|
|
|
2. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
е |
т |
|
е |
н |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
||||
|
|
|
1. Елемент – органоген. (Гідроген)
2. Природне джерело вуглеводнів. (Нафта )
3. Органічні сполуки, що складаються з Карбону і Гідрогену. (Вуглеводні )
4. Газ, що становить основу атмосфер Юпітера і Сатурна (Рудниковий газ) (Метан)
|
1. г |
|
|
|
|
і |
|||
|
д |
3. в |
4. м |
|
|
р |
2. н |
у |
е |
|
о |
а |
г |
т |
|
г |
ф |
л |
а |
|
е |
т |
е |
н |
|
н |
а |
в |
|
|
|
|
о |
|
|
д |
|||
|
н |
|||
|
і |
Кросворд „Етин”
|
|
1. |
|
|
|
|
е |
|
|
|
|
|
|
2. |
|
|
|
|
т |
|
|
|
|
|
|
|
3. |
|
|
|
|
|
и |
|
|
|
|
|
|
|
|
4. |
|
|
|
н |
|
|
|
|
|
1.Хімічний зв’язок, яким утворена переважна більшість органічних сполук
(Ковалентний)
2.Вид хімічних формул, що є мовою органічної хімії (Структурна)
3.Змішування та вирівнювання орбіталей (Гібридизація)
4.Розділ хімії, що вивчає сполуки Карбону (Органічна)
|
|
1.к |
о |
в |
а |
л |
е |
н |
т |
н |
и |
й |
|
2.с |
т |
р |
у |
к |
т |
у |
р |
н |
а |
|
|
|
3.г |
і |
б |
р |
и |
д |
и |
з |
а |
ц |
і |
я |
|
|
|
4.о |
р |
г |
а |
н |
і |
ч |
н |
а |
|
Молодці. Ключові слова – етен та етин. А що ви знаєте про них?
IV. Мотивація навчальної діяльності.
Дуже цікавою є властивість етилену прискорювати достигання багатьох городніх і садових плодів (помідорів, динь, груш, лимонів тощо). Використовуючи це, плоди можна транспортувати ще зеленими, а потім доводити їх до стиглого стану уже на місці споживання, вводячи в повітря складських приміщень невеликі кількості етилену.
Ацетилен у природі майже не трапляється. Причина полягає у високій реакційній здатності цієї сполуки. Застосування ж ацетилену ґрунтується насамперед на використанні теплової світлової енергії, яка виділяється під час його горіння. Ацетиленові (карбідні) ліхтарі використовували у велосипедних і автомобільних фарах, на маяках тощо. Спелеологи та дигери й досі застосовують карбідні ліхтарі під час мандрівок підземними лабіринтами. За допомогою високотемпературного ацетиленокисневого полум'я зварюють і ріжуть метали.
Отож тема нашого уроку „Етен (етилен) і етин (ацетилен) як представники ненасичених вуглеводнів. Молекулярні, електронні та структурні формули. Фізичні властивості.” Це перший урок по вивченню даних речовин та гомологічних рядів, які вони представляють.
І я хотіла б, щоб ми з вами визначили ті основні завдання, які маємо вирішити протягом уроку. А саме:
1) Встановити молекулярні, електоронні та структурні формули етилену та ацетилену, з’ясувати їх фізичні властивості;
2) ознайомитись із природою зв’язків, якими ці речовини утворені та за допомогою кулестержневих моделей виготовити моделі їх молекул;
3)Визначити типи хімічних зв’язків у молекулах етену і етину та порівняти їх з етаном, заповнюючи порівняльну таблицю.
Для чого нам необхідно все це знати?
Може якось можна обійтися без цього?
(Використання методики незакінчених речень:
"Гадаю, що...."
"Сподіваюся , що мені це … "
"Думаю це знати необхідно, тому що... ")
V. Вивчення нового матеріалу
1) Визначимо молекулярні формули етилену та ацетилену, знаючи, що їх відносна густина за воднем дорівнює 14 та 13 відповідно, а у складі молекули міститься по два атоми Карбону.
Дано : Рішення
D1 (Н2) =14 D (Н2) = М(газу) / М(Н2)
D2 (Н2) =13 М1(газу)=2∙ D (Н2) =2∙ 14 =28г/моль n(C) = 2 М2(газу)=2∙ D (Н2) =2∙ 13 =26г/моль
Знайти : М1(С)= 2∙ 12 =24 г/моль, отже М(Н) =28-24=4 г/моль
М.Ф. М2(С)= 2∙ 12 =24 г/моль, отже М(Н) =26-24=2 г/моль
Відповідь: М.Ф. етилену – С2Н4, ацетилену - С2Н2
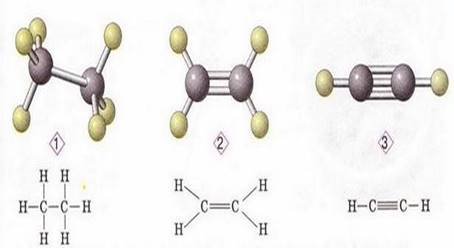
2) Склад етилену і ацетилену підказує, що молекули їх побудовані симетрично, тобто кожний атом Карбону сполучений з однаковою кількістю атомів Гідрогену. Чи відповідають ці М.Ф. загальній формулі насичених вуглеводнів?
Отже, молекули етилену та ацетилену мають іншу будову. А яку ... ,з’ясуємо за допомогою ПМК
Робота з ПМК
§11Етилен. Гомологи етилену
• Склад і будова молекул
• Ізомерія
• Номенклатура
• Фізичні властивості
§13Ацетилен.Гомологи ацетилену
• Склад і будова молекул
• Ізомерія ,номенклатура
• Фізичні властивості
V. Формування вмінь і навичок. • Колективне складання таблиці
|
Ознаки порівняння |
Етан |
Етилен |
Ацетилен |
|
Тип гібридизації атома Карбону |
sp3 |
sp2 |
sp |
|
Види зв’язку |
C – H (сигма) C – C (сигма) |
C – H (сигма) C = C (σ- сигма і π - пі ) |
C – H (сигма) C ≡ C (σ- сигма і 2π -пі ) |
|
Валентний кут |
109,5٥ |
120٥ |
180٥ |
|
Довжина зв’язку, нм |
0,154 |
0,134 |
0,120 |
|
Енергія зв’язку, кДж/моль |
374,4 |
611,1 |
839 |
VІ. Домашнє завдання
Опрацювати §27 підручника(до хімічних властивостей ); Ст..160 №31 - 315
Творче завдання. Підготувати повідомлення про застосування етилену та ацетилену, виготовити їх масштабні моделі.
VІІ. Рефлексія.
- Над чим замислювались протягом уроку?
- Що найбільше сподобалось, запам’яталось?
- Що могло б бути краще ?
VIІІ. Оцінювання роботи учнів .
-
-
-
Дякую!


про публікацію авторської розробки
Додати розробку
