Конспект "Взаємодія води з оксидами. Поняття про індикатори. Лабораторний дослід №8".
Шеіна Тетяна Володимирівна, учитель хімії і біології Парутинської загальноосвітньої школи І-ІІІ ступенів Куцурубської ОТГ
Тема: Взаємодія води з оксидами. Поняття про індикатори. Лабораторний дослід №8.
Мета: освітня: поглибити знання учнів про воду; ознайомити учнів зі взаємодією води з оксидами металічних та неметалічних елементів; дати поняття про основи і кислоти; ознайомити з поняттями: кислоти, основи, індикатори; звернути увагу учнів на техніку безпеки під час роботи з кислотами та основами; з’ясувати, як утворюються кислотні дощі, показати їхній негативний вплив на екологію;
розвивальна: удосконалювати навички висувати гіпотези, перевіряти їх дослідним шляхом, писати рівняння відповідних реакцій; удосконалювати практичні навички роботи з хімічними речовинами;
виховна: виховувати в учнів допитливість, прагнення брати активну участь у пошуку нових знань та збереженні чистоти довкілля.
Тип уроку: комбінований, класно-дистанційний урок
Форма уроку: класно-дистанційна
Засоби навчання: тести на порталі «Всеосвіта», навчальні відеоролики, таблиці, мультимедійна презентація, робочий зошит, обладнання для домашнього експерименту (столовий оцет, лимонна кислота, сода, вода, нашатирний спирт, рідке мило, склянки, ложка, рослинний індикатор на вибір учня (капуста, буряк тощо))
Перелік он-лайн сервісів, які використані на уроці: освітній портал «Всеосвіта», канал YouTube, слайди презентації, мобільний телефон чи інший гаджет.
Методи, прийоми: демонстрації, ілюстрації, відео, експеримент, дослідження, пошук.
Хід уроку.
I. Організація класу до уроку
Повідомлення учням про початок уроку у чаті вайбер-спільноти учнів 7 класу.
II. Актуалізація та корекція опорних знань учнів
Виконання тесту на порталі «Всеосвіта». Посилання https://vseosvita.ua/test/blits-opytuvannia-voda-125047.html
III. Перевірка д/з
Аналіз виконаного тесту попереднього дистанційного уроку
IV. Мотивація навчальної діяльності
Слайд 1

V. Вивчення нового матеріалу
1. Вода виявляє достатню хімічну активність. Вона взаємодіє з багатьма простими і складними речовинами, серед яких є і оксиди. Саме такі хімічні властивості води ми і розглянемо.
Таблиця 1.
Перегляд відео за посиланням.
Запишіть приклади рівнянь реакції взаємодії води з основними і кислотними оксидами
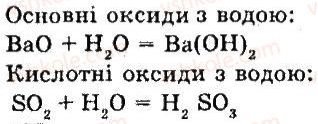
2. Перегляньте відео демонстрацію дослідів взаємодії металічних і неметалічних оксидів з водою.
Запишіть рівняння реакції взаємодії СаО з водою і Р2О5 з водою
СаО +Н2О = Са(ОН)2
Р2О5 + 3Н2О = 2Н3РО4
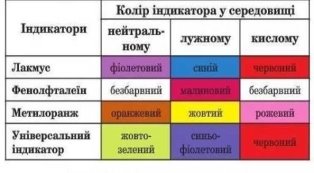
3. Розчини лугів і кислот, які утворюються при взаємодії оксидів з водою, здатні змінювати забарвлення особливих речовин, які називаються – індикаторами. Перейдіть за посиланням https://e-kolosok.org/naukova-robota-pryrodni-kyslotno-osnovni-indykatory/ та ознайомтесь із розділом 1.1 в якому ви дізнаєтесь, що таке індикатори, якими вони бувають та історію їх відкриття.
Перегляньте відео про індикатори https://www.youtube.com/watch?v=CdYOSUUra7o
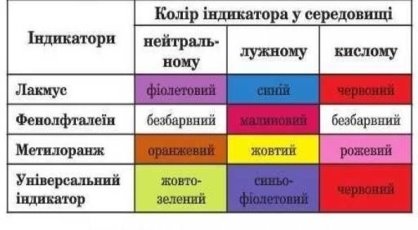
Розгляньте Таблицю 2 «Колір індикатора у середовищі»
Таблиця 2.
4. Багато індикаторів є синтетичними, тобто не природного походження. Це забезпечує їхню стійкість та точність аналізу, адже синтетичний індикатор – це речовина певного складу, на відміну від рослинних індикаторів, які часто є сумішшю різних природних речовин, мають обмежену стійкість і не завжди дають точні і відтворювані результати. Індикатори можна добути з багатьох рослин, яким притаманне забарвлення.
Колір рослин визначається хімічним складом клітинного вмісту кожної рослини (пігментом). Пігменти – органічні сполуки, які присутні в клітинах і тканинах рослин та надають їм певного забарвлення.
Накопичуються пігменти у корінні, у квітках, у шкірці плодів і в листках рослин. Розташовані пігменти в хлоропластах і хромопластах. Пігменти багатьох рослин здатні змінювати колір залежно від кислотності клітинного соку. Тому пігменти є індикаторами, які можна застосувати для дослідження кислотності розчинів.
Хлорофіл надає зеленого забарвлення листкам. Без цього смарагдового пігменту неможливе життя на планеті, оскільки він приймає участь у фотосинтезі.
Супутниками хлорофілу є каротиноїди, які надають жовте, помаранчеве і червоне забарвлення. Так, жовті зерна кукурудзи, помаранчева шкірка мандарина, червоні плоди шипшини своїм забарвленням зобов'язані каротиноїдам.
Флавоноїди – це жовті, коричневі пігменти рослин.
Антоціани, які надають практично всі кольори рослинам — від помаранчевого та червоного до синього. Вони мають добре виражені індикаторні властивості.
Слайд 2.

Природні індикатори мають і переваги, і недоліки.
Недоліки природних індикаторів: їх відвари досить швидко псуються – скисають або пліснявіють, тому частіше використовують більш стійкий спиртовий розчин. Інший недолік – дуже широкий інтервал зміни кольору. При цьому важко або неможливо відрізнити, наприклад, нейтральне середовище від слабо кислого або слабо лужне від сильно лужного.
Позитивним моментом є те, що вони екологічно безпечні і їх можна приготувати і використовувати в домашніх умовах.
Виготовлення індикаторів у домашніх умовах.
Для приготування розчинів індикаторів з рослинної сировини рекомендується, використовувати забарвлені рослини або їх частини. Вибір рослинного матеріалу для приготування індикаторів необмежений.
Головне – щоб виготовлені індикатори відповідали певним вимогам:
- мають бути слабкою кислотою або слабкою основою;
- молекули і йони повинні мати різне забарвлення;
- забарвлення має бути надзвичайно інтенсивним, щоб його можна було помітити при додаванні до досліджуваного розчину навіть малої кількості індикатора.
Можливі 3 шляхи приготування розчинів індикаторів з природної сировини:
а) подрібнити потрібний матеріал та вичавити з нього сік. Отриманий сік розвести водою або спиртом для довшого зберігання.
б) подрібнити потрібний матеріал, залити його гарячою водою і настояти. Згодом відфільтрувати і використовувати фільтрат як індикатор.
в) приготувати відвар – подрібнений матеріал недовго прокип’ятити, настояти до охолодження розчину, відфільтрувати.
Слайд 3.

Перегляньте відео демонстрацію досліду з використанням рослинних індикаторів за посиланням https://www.youtube.com/watch?v=84QkoBFydtw
5. Лабораторний дослід №8. Виконайте дослід в домашніх умовах з використанням природного індикатору на ваш вибір (капуста, буряк тощо) скориставшись Слайдом 3. Звіт оформіть у Таблицю 3.
Таблиця 3.
|
Індикатор |
Назва речовини |
Колір (до додавання індикатора) |
Колір (після додавання індикатора) |
Середовище (нейтральне, лужне, кислотне) |
|
|
Столовий оцет |
|
|
|
|
|
Водний розчин соди |
|
|
|
|
|
Нашатирний спирт |
|
|
|
|
|
Водний розчин рідкого мила |
|
|
|
|
|
Водний розчин лимонної кислоти |
|
|
|
Для успішного виконання завдання скористайтеся також Таблицею 4.
Таблиця 4.
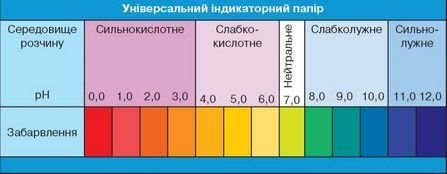
6. Кислотний дощ утворюється в результаті реакції між водою й оксидами Сульфуру та Нітрогену. Природними джерелами надходження сульфур (ІV) оксиду в атмосферу є вулкани й лісові пожежі, оксиди Нітрогену утворюються в результаті електричних розрядів під час сильних злив. Реагуючи з водою атмосфери, вони перетворюються на розчини кислот. т Чи може людина завдяки своїй господарській діяльності збільшувати кількість газуватих оксидів неметалічних елементів, які з водою можуть утворювати кислоти? Оксиди Сульфуру й Нітрогену потрапляють в атмосферу через автомобільний транспорт, у результаті діяльності металургійних підприємств і електростанцій, а також під час спалювання вугілля і деревини. Перегляньте відео про кислотні дощі.
https://www.youtube.com/watch?v=urJZkYxTeLY
Знайдіть у мережі Інтернет статтю: «Вирішення проблеми кислотних дощів?». Скопіюйте посилання на статтю та надішліть вчителю.
VI. Осмислення, узагальнення та систематизація знань
Зворотній зв'язок з учнями 7 класу у чаті вайбер-спільноти щодо засвоєння нового матеріалу.
VII. Підведення підсумків уроку
Оцінки за урок будуть виставленні в електронний журнал, кожен учень окремо зможе побачити свою оцінку в своєму робочому кабінеті хімії після перевірки домашнього завдання вчителем.
VIII. Повідомлення д/з
- Перегляньте відеоуроки та відеодосліди, зробіть записи рівнянь у робочому зошиті.
- Дотримуючись правил безпеки, виконайте дослід з використанням природного індикатора на ваш вибір (капуста, буряк тощо).
- Оформіть звіт про виконання досліду у Таблицю 3 в робочому зошиті і разом з відео (необов’язково/за бажанням) та фото (обов’язково) виконаного досліду надішліть вчителю у Viber або Меssenger в особисті повідомлення.
- Знайдіть у мережі Інтернет статтю: «Вирішення проблеми кислотних дощів?». Скопіюйте посилання на статтю та надішліть вчителю.
Список використаних джерел
- Відеоролик на каналі YouTube «Що таке кислотні дощі? Природні катаклізми і як з ними боротися. Екологія 13+» https://www.youtube.com/watch?v=urJZkYxTeLY
- Відеоролик на каналі YouTube «Індикатори. Хімія 7 клас». https://www.youtube.com/watch?v=CdYOSUUra7o
- Відеоролик на каналі YouTube «Рослинні індикатори». https://www.youtube.com/watch?v=84QkoBFydtw
- Відеоролик на каналі YouTube «Реакція води з оксидами. Хімія 7 клас». https://youtu.be/cF98mV062tc
- Відеоролик на каналі YouTube 17. Демонстрація «Взаємодія кальцій оксиду з водою». https://youtu.be/kjtGcveOosY
- Відеоролик на каналі YouTube 18. Демонстрація «Взаємодія фосфор оксиду з водою». https://youtu.be/SReeiN0wuDs
- Сайт «Колосок\колосочок», наукова робота «Природні кислотно-основні індикатори», розділ І літературний огляд, 1.1 індикатори. https://e-kolosok.org/naukova-robota-pryrodni-kyslotno-osnovni-indykatory/
- Блог вчителя хімії Білинська О.С., проект «Рослини-індикатори та їх застосування» http://bosaolebb.blogspot.com/p/blog-page_425.html
- Таблиця 1. https://svitppt.com.ua/images/10/9061/770/img14.jpg
- Таблиця 2. https://eschool.dn.ua/pluginfile.php/355861/mod_page/content/3/%D1%96%D0%BD%D0%B4%D0%B8%D0%BA.jpg
- Таблиця 4. https://mozok.click/uploads/khimija-9-savchyn-2017/khimija-9-savchyn-2017-82.jpg
- Тести на порталі «Всеосвіта» https://vseosvita.ua/test/blits-opytuvannia-voda-125047.html
Додаток 1.
Структура комбінованого класно-дистанційного уроку
|
Етап уроку |
Хід уроку. Ресурси |
Форма перевірки виконаних завдань |
Додаткові матеріали до уроку: Інтернет-ресурси, програми |
|
I. Організація класу до уроку |
Повторення правил ТБ з ПК |
|
Viber |
|
II. Актуалізація та корекція опорних знань учнів |
Перейди за посиланням: https://vseosvita.ua/test/blits-opytuvannia-voda-125047.html |
Фронтально |
Освітній портал «Всеосвіта» |
|
|
|
|
|
|
III. Перевірка д/з |
Аналіз виконаного тесту у дистанційному курсі |
Фронтально |
Освітній портал «Всеосвіта» |
|
IV. Мотивація навчальної діяльності |
Проблемні питання |
|
Презентація до уроку |
|
V. Вивчення нового матеріалу |
Відеоуроки, відео демонстрації дослідів https://www.youtube.com/watch?v=CdYOSUUra7o |
|
Канал YouTube, Інтерактивне навчання «Ранок» |
|
VI. Осмислення, узагальнення та систематизація знань |
Зворотній зв'язок з учнями |
Пояснення вчителя |
Viber, особисті повідомлення |
|
VII. Підведення підсумків уроку |
Індивідуальний звіт-оцінок за урок |
Оголошення результатів, виставлення оцінок до електронного журналу |
Електронний журнал |
|
VIII. Повідомлення д/з |
Асинхронний режим 1. Перегляньте відеоуроки та відеодосліди, зробіть короткий конспект в робочому зошиті. 2. Дотримуючись правил безпеки, виконайте дослід з використанням природного індикатора на ваш вибір (капуста, буряк тощо). 3. Оформіть звіт про виконання досліду у Таблицю 3 в робочому зошиті і разом з відео (необов’язково/за бажанням) та фото (обов’язково) виконаного досліду надішліть вчителю у Viber або Меssenger в особисті повідомлення. 4. Знайдіть у мережі Інтернет статтю: «Вирішення проблеми кислотних дощів?». Скопіюйте посилання на статтю та надішліть вчителю. |
Пояснення вчителя |
|
Додаток 2
Інструкційна картка для учня
(Асинхронне заняття)
Автор: Шеіна Т.В.., учитель Парутинської загальноосвітньої школи І-ІІІ ступенів Куцурубської ОТГ
Завдання:
- Переглянь відеоурок
Реакція води з оксидами https://youtu.be/cF98mV062tc
Запиши рівняння реакцій
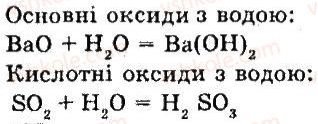
- Переглянь відео демонстрацію дослідів взаємодії металічних і неметалічних оксидів з водою.
Взаємодія кальцій оксиду з водою https://youtu.be/kjtGcveOosY
Взаємодія фосфор (V) оксиду з водою https://youtu.be/SReeiN0wuDs
Запиши рівняння реакції взаємодії СаО з водою і Р2О5 з водою
СаО +Н2О = Са(ОН)2
Р2О5 + 3Н2О = 2Н3РО4
- Перейди за посиланням https://e-kolosok.org/naukova-robota-pryrodni-kyslotno-osnovni-indykatory/ та ознайомся із розділом 1.1 в якому ти дізнаєшся, що таке індикатори, якими вони бувають та історію їх відкриття.
Переглянь відео про індикатори https://www.youtube.com/watch?v=CdYOSUUra7o
Розглянь Таблицю 2 «Колір індикатора у середовищі»
Таблиця 2.
- Виконай лабораторний дослід №8
Тема: «Визначення кислотно-лужної реакції середовища водних розчинів деяких речовин природним індикатором»
Мета: навчитися розпізнавати дослідним шляхом кислотно-лужні середовища.
Інтерактивне навчання
Хід роботи
Завдання 1.
Переглянь відео демонстрацію досліду «Рослинні індикатори» https://www.youtube.com/watch?v=84QkoBFydtw Виготови індикатор та реактиви для досліду, використовуючи Слайд 3. Проведи дослід (зняти на відео чи зробити фото «до і після» зміни кольору) і надішли вчителю у Viber або Меssenger в особисті повідомлення.
Слайд 3

Завдання 2.
Результати досліду запиши у Таблицю 3, зроби висновок визначивши середовища за допомогою Таблиці 4 і надішли вчителю у Viber або Меssenger в особисті повідомлення.
Таблиця 3
|
Індикатор |
Назва речовини (реактиви) |
Колір (до додавання індикатора) |
Колір (після додавання індикатора) |
Середовище (нейтральне, лужне, кислотне) |
|
|
Столовий оцет |
|
|
|
|
|
Водний розчин соди |
|
|
|
|
|
Нашатирний спирт |
|
|
|
|
|
Водний розчин рідкого мила |
|
|
|
|
|
Водний розчин лимонної кислоти |
|
|
|
Таблиця 4

Для допитливих
- Переглянь відео про кислотні дощі.
https://www.youtube.com/watch?v=urJZkYxTeLY
Знайди у мережі Інтернет статтю: «Вирішення проблеми кислотних дощів?». Скопіюй посилання на статтю та надішли вчителю.
Висновок: Для формулювання узагальнюючого висновку використай відповідь на запитання: «Яке значення визначення рН середовища у природі та житті людини»


про публікацію авторської розробки
Додати розробку

