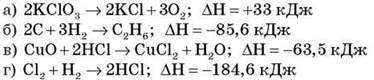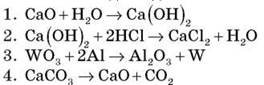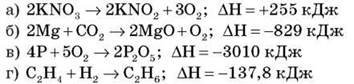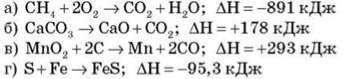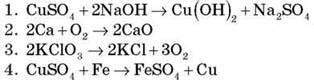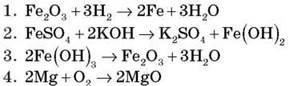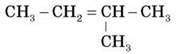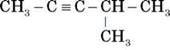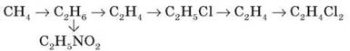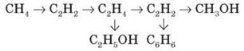Контрольні роботи з хімії 7 - 11 клас

КОНТРОЛЬНА РОБОТА 1 по темі: «ОСНОВНІ ХІМІЧНІ ПОНЯТТЯ» 7 клас
1 рівень ( 3 бали)
Варіант 1:
Речовина – це…..Приклади.
Суміш – це…..Приклади.
Атом – це…….Малюнок.
Варіант 2:
Класифікація сумішей. Приклади.
Хімічний елемент – це……
Абсолютно чиста речовина :……..(формула, назва речовини).
Варіант 3:
Неоднорідні суміші – це…….Приклади.
Однорідні суміші – це…….Приклади.
Прості речовини – це…….Приклади.
Варіант 4:
З яких частинок складається атом? Характеристика (заряд, маса).
Орбіталь – це……..
Складні речовини – це……..Приклади.
Варіант 5:
Період – це…….Скільки є періодів? Як поділяються?
Група – це……..Скільки є груп? Як поділяються?
До яких періодів та груп належать лантаноїди та актиноїди?
Варіант 6:
Охарактеризувати будову атома (малюнок).
Відносна атомна маса – це…….
Формула на обчислення відносної атомної маси:………
Варіант7:
Матеріал – це…….Приклади.
Напишіть символи хімічних елементів, назви та вимова яких не співпадають.
Фізичне тіло – це……….Приклади.
2 рівень ( 3 бали)
ЗАВДАННЯ
- Розподілити на Речовини та Фізичні тіла (1 бал)
- Розподілити суміші на Однорідні та Неоднорідні (1 бал)
- Написати план розділення суміші ( 1 бал)
Варіант 1:
- Олівець, колба, залізо, сірка, цвях.
- Олія у воді, залізна стружка і тирса, цукор у воді, крейда і пісок
- Залізна стружка і тирса, цукор
Варіант 2:
- Мідний дріт, алюміній, свічка, віск, пробірка.
- Сіль у воді, молоко, повітря, нафта.
- Пісок, пінопласт, кух.сіль
Варіант 3:
- Оцинкована трубка, олово, поліетилен, обкладинка, книжка.
- Оцет, газована вода, водопровідна вода, глина у воді.
- Спирт , глина та тирса.
Варіант 4:
- Целюлоза, зошит, ключ, срібло, брошка.
- Морська вода, повітря, олія у воді, кров.
- Мідна стружка, цукор, віск.
Варіант 5:
- Мідний дріт, алюміній, свічка, віск, пробірка.
- Олія у воді, залізна стружка і тирса, цукор у воді, крейда і пісок
- Пісок, пінопласт, кух.сіль.
Варіант 6:
- Оцинкована трубка, олово, поліетилен, обкладинка, книжка
- Оцет, газована вода, водопровідна вода, глина у воді.
- Спирт , глина та тирса.
Варіант 7:
- Спирт , глина та тирса.
- Сіль у воді, молоко, повітря, нафта.
- Пісок, пінопласт, кух.сіль.
3 рівень ( 3 бали )
Охарактеризувати за планом запропоновані вашому варіанту хімічні елементи
ПЛАН
Номер,хімічний символ та назва елемента
- Період - ……(великий або малий,не завершений). З якими елементами межує?
- Група:…….(головна або побічна).З якими елементами межує?
- Ряд:…….(парний або не парний)
- Відносна атомна маса:……..Аr( Е ) = ?.
Порівняйте масу вашого хім.елеиента, у скільки разів більша, ніж маса Флуору. Порівняйте, на скільки більша маса вашого елемента, ніж маса Гелію.
- Протони ( р): ……
- Нейтрони (n):…..
- Електрони (е):……
Варіант 1: №11, 13.
Варіант 2: № 55, 14,
Варіант 3: №, 22, 99
Варіант 4: ,№ 30, 62
Варіант 5: № 88, 28.
Варіант 6: № 87, 7.
Варіант 7: № 38, 9.
4 рівень ( 3 бали)
Хімічні формули речовин:
А) води…?…..
Б) кисню…?…..
В) вуглекислого газу?………
Г) кухонної солі…?…….
Знаючи , як знайти відносні атомні маси хімічних елементів, з яких складаються формули цих речовин, обчисліть маси молекул.
|
КОНТРОЛЬНА РОБОТА 2 ПО ТЕМІ "ОСНОВНІ ХІМ.ПОНЯТТЯ" 7 КЛАС |
|
1 РІВЕНЬ (3 БАЛИ) Варіант 1 1) Валентність - це.... 2) Валентність Оксигену:...... 3)Відноснамолекулярнамаса - це.... Варіант 2 1) Масовачасткаелементів - це.... 2)Формула на обчисленнямасовоїчастки:.... 3)ВалентністьГідрогену:... Варіант 3 1)Простіречовини - це....Приклади. 2)Фізичніявища - це....Приклади. 3)Валентність Хлору в бінарнихсполуках:.....(коли хім.елемент на другому місці) Варіант 4 1)Складніречовини - це....Приклади. 2)Хімічніявища - це....Приклади. 3)ВалентністьСульфуру в бінарнихсполуках:....(коли хім.елемент на другому місці) Варіант 5 1)Ознакихім.явищ:а).....б).......в)........г).......д)........ 2)Хімічніявища - це.....реакції. 3)ВалентністьМагнію:..... Варіант 6 1)Реагентиабовихідніречовини - це..... 2)Продуктиреакції-це...... 3)ВалентністьФеруму:......та.........
2 РІВЕНЬ(3 БАЛИ) 1. Скластиформули за валентністю: Варіант 1:CaO, ALO, Fe(III)O, P(V)O Варіант 2:Mn(VII)O, Mn(III)O, Mn(II)O, Mn(IV)O Варіант 3:Cr(II)O, Cr(III)O, Cr(VI)O, Cu(I)O Варіант 4:CL(I)O, CL(III)O, CL(VII)O, Cu(II)O Варіант 5:P(III)O, P(V)O, Pb(IV)O, Pb(II)O Варіант 6:S(VI)O, S(IV)O, CaO, NaO 2.Вказати валентністьхім.елементів у формулах: Варіант 1:BaO, BaCL2, Na2S, PH3 Варіант 2: NaCL, Al2S3, P2O5, CH4, Варіант 3: HCL, Fe2O3, K2S, H2Te Варіант 4:Li2O, MgCL2, AsH3, Fe2S3 Варіант 5: PCL5, P2O5, SiH4, K2O Варіант 6: PH3, CL2O7, H2O, Na2S 3. Обчислитивідносні молекулярнімасиречовин, формулияких: Варіант1:CL2, P2O5, H2SO4, Ca3(PO4)2 Варіант2:CL2O7, N2 , H2CO3, (NH4)2S Варіант3:O3, N2O5, H2SiO3, Al2(SO4)3 Варіант 4:Br2, (NH4)2CO3, H2MnO4, Cr2O3 Варіант 5:Br2O7, Cl2, Al2(SO4)3, HIO4 Варіант6:O3, AL2O3, H3PO4, (NH4)3PO4
3 РІВЕНЬ (3 Бали) Розв"язати задачу. Варіант1: 1)Визначитимасовічасткиелементіввречовині: (NH4)2SO4 2) До складу речовинивходять:Сульфур - 40% та Оксиген - 60%. Яка формула речовини? Обчислитивідноснумолекулярнумасу. Варіант 2: 1)Визначитимасовічасткиелементівв речовині:Ca3(PO4)2 2) До складу речовинивходять:Нітроген - 36,84% та Оксиген - 63,16%. Яка формула речовини? Обчислитивідноснумолекулярнумасу. Варіант 3: 1)Визначитимасовічасткиелементіввречовині:(NH4)3PO4 2)До складу речовинивходять: Силіцій - 46,67% та Оксиген - 53.33%.Яка формула речовини? Обчислитивідноснумолекулярнумасу. Варіант 4: 1)Визначитимасовічасткиелементівв речовині:AL2(SO4)3 2)До складу речовинивходять:Купрум - 66,6% та Сульфур - 33,4%.Яка формула речовини? Обчислитивідноснумолекулярнумасу. Варіант 5: 1)Визначитимасовічасткиелементіввречовині:Zn(NO3)2 2)До складу речовинивходять: Карбон - 75% та Гідроген - 25%. Яка формула речовини? Обчислитивідноснумолекулярнумасу. Варіант 6: 1) Визначитимасовічасткиелементіввречовині:(NH4)2CO3 2)До складу речовинивходять: Гідроген - 5.88% та Сульфур - 94,12%.Яка формула речовини? Обчислитивідноснумолекулярнумасу. 4 РІВЕНЬ (3 Бали) Варіант 1:Відносна молекулярнамаса оксиду у 38 разівбільшавідвідносноїмолекулярноїмасиводню (Н2).До його складу входять:Нітроген - 36.84% та Оксиген. ЗНАЙДІТЬ ФОРМУЛУ ОКСИДУ. Варіант 2:Відносна молекулярнамасаречовини у 10 разівбільшавідвідносноїмолекулярноїмаси метану (СН4).До його складу входять:Ферум - 70% та Оксиген. ЗНАЙДІТЬ ФОРМУЛУ. Варіант 3:Відносна молекулярнамасачотиривалентногоелемента в оксиді - 64, а масовачастка Оксигену в ньому - 50 %.Яка формула речовини? Варіант 4:Відносна молекулярнамасаречовини у 71 разівбільшавідвідносноїмолекулярноїмасиводню (Н2).До його складу входять : Фосфор - 43,66% та Оксиген. Знайдіть формулу речовини.. Варіант 5:Відносна молекулярнамасашестивалентногоелемента в оксиді - 80,а масовачастка Оксигену в ньому - 60 %.Яка формула речовини? Варіант 6: Відноснамолекулярнамасап"ятивалентногоелемента в оксиді - 142, а масовачастка Оксигену в ньому - 56,34 %.Яка формула речовини? |
7 клас
Контрольна робота №3 (семестрова 2 )
1 рівень (3 бали)
В-1:Відносна атомна маса- це…(правило).
В-2:Відносна молекулярна маса-це…(правило).
В-3:Відносна масова частка (w%)-це….(правило або формула).
В-4:Валентність-це…(правило).
В-5:Оксиди- це….(правило).
В-6:Горіння – це….(правило).
В-7:Окиснення – це….(правило).
В-8:Каталізатор-це….(правило).
В-9:Фізичні явища-це……(правило)
В-10:Хімічні явища-це…(правило).
2 рівень (3 бали)
Визначити валентність хім.елементів.
У підкресленій хім .формулі обчислити відносну молекулярну масу та відносні масові частки хім.елементів (w%).
В-1:CaO, Al2O3,Li2O,PH3.
В-2:BaO,Fe2O3,Na2O,CH4.
В-3:SrO,Cr2O3,K2O,AsH4.
В-4:FeO,Mn2O3,Rb2O,H2S.
В-5:PbO,Cl2O7,SnO2,H2Se.
В-6:BeO,Br2O7,PbO2,H2Te.
В-7:ZnO,Mn2O7,Sc2O3,NH3.
В-8:CuO,P2O3,SO2,HCl.
В-9:MnO,P2O5,SO3,HF.
В-10:CrO,As2O5,WO3,HI.
3 рівень (3 бали)
Скласти хім.формули (на відповідність). Написати хім.рівняння реакцій з водою. Урівняти.
(1,5 бали)
В-1:SO2 H2SO4
SO3 H2CO3
CO2 H2SO3
Al2O3 NaOH
В-2:P2O5 HPO3
As2O5 HNO3
N2O5 NaOH
ZnO H3AsO4
В-3:Li2O Mg(OH)2
CaO CsOH
MgO Ca(OH)2
BeO LiOH
В-4:BaO NaOH
Na2O LiOH
MgO Ba(OH)2
Fe2O3 Mg(OH)2
В-5:FeO KOH
K2O H2SO4
HgO Hg(OH)2
ZnO Fe(OH)2
В-6:Rb2O H2SO3
Al2O3H2SO4
SO3 RBOH
SO2 Pb(OH)2
В-7:CO2 Ba(OH)2
P2O5 H2CO3
BeO H3PO4
BaO PB(OH)2
В-8:SiO2 HNO3
N2O5 H2SO3
MgO Mg(OH)2
FeO Fe(OH)2
В-9:K2O CsOH
ZnO H2CO3
SO3 H2SO4
CO2 KOH
В-10:Na2O H2CO3
CaO Ca(OH)2
SiO2 H2SO3
CO2 NaOH
Скласти хім.рівняння реакцій. Урівняти. Дати назви утвореним оксидам.(1,5 бали)
В-1:Ba+O2=….
Li+O2=…..
P+O2=….
Fe(III)+O2=…
В-2:Li+O2=….
Cr(II)+O2=....
Mg+O2=…
S(IV)+O2=…
В-3:Na+O2=…
Ca+O2=....
Cl2+O2=….
Pb+O2=…
В-4:C(IV)+O2=…
Zn+O2=…
K+O2=…
W(VI)+O2=….
В-5:Fe(II)+O2=…
P(III)+O2=…
Sr+O2=…
K+O2=….
В-6:Cs+O2=…
Se+O2=…
N2(II) +O2=….
Hg+O2=…
В-7:Si+O2=…
Ba+O2=…
P(V) +O2=…
Mg +O2=….
В-8:Ca+O2=…
V+O2=…
Sc+O2=…
Na+O2=…
В-9:C+O2=…
Te(IV)+O2=….
Mg+O2=…..
Sn+O2=….
B-10: Li+O2=…
Hg(II)+O2=…
Fe(III)+O2=….
Br2+O2=….
4 рівень (3 бали)
Задачі.
Розв’зок оформити починаючи з дано:
|
№ |
mсолі |
mводи |
mрозчину |
W,солі (%) |
|
В-1 |
5гр |
200гр |
? |
? |
|
В-2 |
5гр |
? |
340гр |
? |
|
В-3 |
? |
? |
250гр |
15% |
|
В-4 |
10гр |
150гр |
? |
? |
|
В-5 |
? |
? |
450гр |
25% |
|
В-6 |
8гр |
? |
64гр |
? |
|
В-7 |
80гр |
? |
350гр |
? |
|
В-8 |
? |
? |
360гр |
40% |
|
В-9 |
? |
? |
650гр |
20% |
|
В-10 |
140гр |
640гр |
? |
? |
|
КОНТРОЛЬНА РОБОТА 4 по темі: «Простіречовини( кисень)» 7 клас |
||||||||||||||||||||||||
|
Варіант І І рівень (3 бали) 1. (0,5 бала) Укажіть хімічний символ Оксигену:.................
2. (0,5 бала) Укажіть молекулярну (формульну) масу кисню:...............
3. (0,5 бала) Укажіть фізичні властивості притаманні кисню:...............
4. (0,5 бала) Кисень в промисловості одержують:..............
5. (0,5 бала) Назвіть прізвище вченого, якого вважають першовідкривачем кисню:............
6. (0,5 бала) Якщо в пробірку з киснем внести тліючу скіпку, вона:............... \ ІІ рівень 7. (1,5 бала) Установіть відповідність між поняттям та його визначенням:
8. (1,5 бала) Складіть формули наступних оксидів: Алюміній оксид, карбон (ІV) оксид, гідроген оксид, сульфур (VI) оксид ІІІ рівень 9. (1 бал) Складіть рівняння реакцій: а) S + О2 → б) Н2S + О2 → в) Fe + О2 → 10. (1 бал) Розрахуйте масову частку Оксисену в Al2O3. 11. (1 бал) Здійсніть ланцюжок перетворень за схемою (написати хім.реакцію): С→ СО2 Дати назву продукту реакції. ІV рівень 12. (1 бал) Визначте валентність елементів у наведених оксидах, назвіть ці оксиди: CaO, Cl2O7, N2O, SiO2. 13. (1 бал) Реакції, у яких з однієї речовини утворюється декілька інших речовини, називають…Наведіть загальний вигляд даної реакції. Складіть хімічне рівняння даної реакції з калій перманганату. 14. (1 бал ) Деяка сполука Гідрогену з Оксисену містить 94,12% оксигену. Відносна молекулярна маса цієї сполуки – 34 а.о.м. Визначте формулу сполуки НxOy.
Варіант ІІ І рівень (3 бали) 1. (0,5 бала)Укажіть хімічну формулу кисню:........
2. (0,5 бала) Укажіть відносну атомну масу Оксигену:..........
3. (0,5 бала)Укажіть фізичні властивості притаманні озону:.........
4. (0,5 бала)Кисень у лабораторії одержують розкладанням:..............
5. (0,5 бала) Назвіть прізвище вченого, який відкрив закон збереження маси:..................... 6. (0,5 бала) Кисень можна збирати способом витіснення води, тому, що він за стандартних умов:...........
ІІ рівень 7. (1,5 бала) Установіть відповідність між поняттям та його визначенням:
8. (1,5 бала) Складіть формули наступних оксидів: Ферум(ІІІ) оксид, карбон (ІІ) оксид, кальцій оксид, натрій оксид ІІІ рівень 9. (1 бал) Складіть рівняння реакцій: а) С + О2 → б) СН4 + О2 → в) Al + О2 → 10. (1 бал) Розрахуйте масову частку Оксисену в Fe2O3. 11. (1 бал) Здійсніть ланцюжок перетворень за схемою (написати хім.реакці.): Н2→ Н2О Дати назву продукту реакції.
ІV рівень 12. (1 бал) Визначте валентність елементів у наведених оксидах, назвіть ці оксиди: K2O, P2O3, NO2, SO3. 13. (1 бал) Реакції, у яких із двох простих або складних речовин утворюється одна речовина, називають…Наведіть загальний вигляд даної реакції. Складіть хімічне рівняння даної реакції між глюкозою та киснем. 14. (1 бал) Деяка сполука Купруму з Оксисеном містить 88,9% Купруму. Відносна молекулярна маса цієї сполуки – 144. Визначте формулу сполуки CuxOy.
3 варіант 1 рівень (3 бали) 1.( 0,5 бали) Хім.формула озону:............. 2.(0,5 бали) Напишіть хім.формули газів, які входять до складу повітря:........... 3. (0, 5 бали) Масова частка кисню в повітрі (%):.............. 4.( 0,5 бали) Розрахуйте, у скільки разів кисень важчий за повітря. 5.(0,5 бали) Назвіть прізвище вченого, який запропонував хім. посуд для транспортування рідкого кисню. 6.(0,5 бали) Кисень в зрідженому стані має.....колір.
2 рівень (3 бали) 1. (1,5 бала)
8. (1,5 бала) Складіть формули наступних оксидів: манган(ІV) оксид, купрум(ІІ) оксид, магній оксид, калій оксид ІІІ рівень 9. (1 бал) Складіть рівняння реакцій: а) P + О2 → б) PH3 + О2 → в) Sc + О2 → 10. (1 бал) Розрахуйте масову частку Оксисену в Cl2O7. 11. (1 бал) Здійсніть ланцюжок перетворень за схемою (написати хім.реакцію): Mg→MgО Дати назву продукту реакції. ІV рівень 12. (1 бал) Визначте валентність елементів у наведених оксидах, назвіть ці оксиди: WO3, Cl2O7, N2O, Cr2O3. 13. (1 бал) Реакції, у яких з однієї речовини утворюється декілька інших речовини, називають… Наведіть загальний вигляд даної реакції. Складіть хімічне рівняння даної реакції з гідроген пероксиду. 14. (1 бал) Деяка сполука Карбону з Гідрогеном містить 75% Карбону. Відносна молекулярна маса цієї сполуки – 16 а.о.м. Визначте формулу сполуки CxHy.
4 варіант 1 рівень ( 3 бали ) 1. (0,5 бала) Укажіть хімічну формулу азоту :.................
2. (0,5 бала) Укажіть молекулярну (формульну) масу азоту:...............
3. (0,5 бала) Укажіть фізичні властивості притаманні кисню:...............
4. (0,5 бала) Кисень в промисловості одержують:..............
5. (0,5 бала) Назвіть прізвище вченого, який дослідив властивості кисню:............
6. (0,5 бала) Якщо в пробірку з киснем внести тліючу скіпку, вона:............... 2 рівень (3 бали)
8. (1,5 бала) Складіть формули наступних оксидів: барій оксид, сульфур (ІV) оксид, літій оксид, селен (VI) оксид ІІІ рівень 9. (1 бал) Складіть рівняння реакцій: а) Si + О2 → б) CS2 + О2 → в) Ba + О2 → 10. (1 бал) Розрахуйте масову частку Оксисену в Cl2O7. 11. (1 бал) Здійсніть ланцюжок перетворень за схемою (написати хім.реакцію): P→ P2O5 Дати назву продукту реакції. ІV рівень 12. (1 бал) Визначте валентність елементів у наведених оксидах, назвіть ці оксиди: MnO2, Mn2O3, Mn2O7,MnO. 13. (1 бал) Реакції, у яких із двох простих або складних речовин утворюється одна речовина, називають…Наведіть загальний вигляд даної реакції. Складіть хімічне рівняння даної реакції між глюкозою та киснем. 14. (1 бал) Деяка сполука Сульфуру з Гідрогеном містить 94,11% Сульфуру. Відносна молекулярна маса цієї сполуки – 34. Визначте формулу сполуки SxHy. |
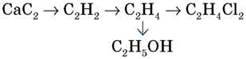
КОНТРОЛЬНА РОБОТА 5 (семестрова2) 7 КЛАС
1 рівень (3 бали)
1) Доповнити правило (1 бал).
Варіант 1: Атом – це…….Малюнок.
Варіант 2: Валентність - це.........Валентність Оксигену:......
ВалентністьГідрогену:....
Варіант 3: Масовачасткаелементів - це....Формула:....
Варіант 4: Простіречовини - це....Приклади.
Варіант 5: Відноснаатомнамаса – це…….Формула:.....
Варіант 6:Хімічніявища - це......Приклади.
2) Вказативалентністьхім.елементів у формулах (1 бал):
Варіант 1: BaO, BaCL2, Na2S, PH3
Варіант 2: NaCL, Al2S3, P2O5, CH4,
Варіант 3: HCL, Fe2O3, K2S, H2Te
Варіант 4: Li2O, MgCL2, AsH3, Fe2S3
Варіант 5: PCL5, P2O5, SiH4, K2O
Варіант 6: PH3, CL2O7, H2O, Na2S
3) Знайтиоксиди. Датиназви оксидам (1 бал):
Варіант1: CL2, P2O5, H2SO4, BaO,Ca3(PO4)2
Варіант2: CL2O7, N2 , H2CO3, (NH4)2S, SO3
Варіант3: Na2O, O3, N2O5, H2SiO3, Al2(SO4)3
Варіант 4: Br2, BaO, (NH4)2CO3, H2MnO4, Cr2O3
Варіант 5: Br2O7, Cl2, Al2O3, Al2(SO4)3, HIO4
Варіант 6: O3, AL2O3, H3PO4, (NH4)3PO4, Mn2O7
2 рівень ( 3 бали)
Розв"язатизадачі (2 бали).
Варіант1:
1) Визначитимасовічасткиелементіввречовині: (NH4)2SO4
2) До складу речовинивходять:Сульфур - 40% та Оксиген - 60%. Яка формула речовини? Обчислитивідноснумолекулярнумасу.
Варіант 2:
1) Визначитимасовічасткиелементівв речовині:Ca3(PO4)2
2) До складу речовинивходять:Нітроген - 36,84% та Оксиген - 63,16%. Яка формула речовини? Обчислитивідноснумолекулярнумасу.
Варіант 3:
1) Визначитимасовічасткиелементіввречовині:(NH4)3PO4
2) До складу речовинивходять: Силіцій - 46,67% та Оксиген - 53.33%.Яка формула речовини? Обчислитивідноснумолекулярнумасу.
Варіант 4:
1) Визначитимасовічасткиелементівв речовині:AL2(SO4)3
2) До складу речовинивходять:Купрум - 66,6% та Сульфур - 33,4%.Яка формула речовини? Обчислитивідноснумолекулярнумасу.
Варіант 5:
1) Визначитимасовічасткиелементіввречовині:Zn(NO3)2
2) До складу речовинивходять: Карбон - 75% та Гідроген - 25%. Яка формула речовини? Обчислитивідноснумолекулярнумасу.
Варіант 6:
1) Визначитимасовічасткиелементіввречовині:(NH4)2CO3
2) До складу речовинивходять: Гідроген - 5.88% та Сульфур - 94,12%.Яка формула речовини? Обчислитивідноснумолекулярнумасу.
3) Скластихім.рівнянняреакцій. Урівняти.( 1 бал):
В-1:
а) Ba+O2=….
б) Li+O2=…..
в) P+O2=….
г) Fe(III)+O2=…
В-2: а) Li+O2=….
Cr(II)+O2=....
Mg+O2=…
S(IV)+O2=…
В-3: Na+O2=…
Ca+O2=....
Cl2+O2=….
Pb+O2=…
В-4: C(IV)+O2=…
Zn+O2=…
K+O2=…
W(VI)+O2=….
В-5:Fe(II)+O2=…
P(III)+O2=…
Sr+O2=…
K+O2=….
В-6: Cs+O2=…
Se+O2=…
N2(II) +O2=….
Hg+O2=…
3 рівень (3 бали)
1) Розв"язати задачу, використовуючи закон збереженнямасиречовин ( 1 бал):
Варіант 1: Яка масаневідомоїречовинирозклалася при нагріванні, якщоутворивсякальцій оксид масою 12,6 грам і карбон (ІV) оксид масою 6,2 грами?
Варіант 2: Яка масаневідомоїречовинизгоріла в киснімасою 8 грам, якщоутворився карбон (ІV) оксид масою 6,76 грам та вода масою 21, 43 грами?
Варіант 3: Яка маса осаду утворилася, якщопровзаємодіяло 24,3 грами гашеного вапнаCa (OH)2 з карбон (ІV) оксидом масою 15,8 грам? Окрім осаду виділилася вода масою 7,6 грам.
Варіант 4:Яка масаневідомоїречовинирозклалася при нагріванні, якщоутворивсякальцій оксид масою 24,6 грам і карбон (ІV) оксид масою 16,2 грами?
Варіант 5:Яка масаневідомоїречовинизгоріла в киснімасою 16 грам, якщоутворився карбон (ІV) оксид масою 23,4 грами та вода масо 11 грам?
Варіант6:Яка маса осаду утворилася, якщопровзаємодіяло 14,3 грами гашеного вапнаCa (OH)2 з карбон (ІV) оксидом масою 25,8 грам? Окрім осаду виділилася вода масою 17,6 грам.
2) Скластихім.формули (на відповідність). Написатихім.рівнянняреакцій з водою. Депотрібно, урівняти. (1 бал).
В-1:SO2 H2SO4
SO3 H2CO3
CO2 H2SO3
Al2O3 NaOH
В-2:P2O5 HPO3
As2O5 HNO3
Nа2O H3AsO4
ZnO NaOH
В-3:Li2O Mg(OH)2
CaO CsOH
MgO Ca(OH)2
BeO LiOH
В-4:BaO NaOH
Na2O LiOH
MgO Ba(OH)2
Fe2O3 Mg(OH)2
В-5: FeO KOH
K2O H2SO4
HgO Hg(OH)2
ZnO Fe(OH)2
В-6:Rb2O H2SO3
Al2O3 H2SO4
SO3 RbOH
SO2 Pb(OH)2
3) Розв"язати задачу (1 бал).
Розв’зок оформити, починаючи з дано:
|
№ |
m,солі |
m,Н2О |
m,р - ну |
W,солі (%) |
|
В-1 |
5 грNaCl |
200 гр |
? гр |
? % |
|
В-2 |
6 гр Na2CO3 |
? гр |
340 гр |
? % |
|
В-3 |
? гр CaCO3 |
? гр |
250 гр |
15% |
|
В-4 |
10 гр KI |
150 гр |
? гр |
? % |
|
В-5 |
? гр KHCO3 |
? гр |
450 гр |
25% |
|
В-6 |
8 гр NaHCO3 |
? гр |
64 гр |
? % |
4 рівень ( 3 бали)
Розв"язати задачу.
Варіант 1: До розчину солі масою 250 гр з масовою часткою солі 20% долили води об"ємом 150 мл. Яка масова частка речовини в утвореному розчині?
Варіант 2: До розчину солі масою 300 грам з масовою часткою речовини 15% долили води масою 200 грам. Знайти масову частку солі в новоутвореному розчині.
Варіант 3: Для засолювання огірків застосовують розчин солі з масовою часткою 6%. Яку масусолі та води треба взяти, щоб приготувати такий розчин масою 2 кг?
Варіант 4: Виготовили розчин цукрумасою 120 грам з масовою часткою цукру 0,2%. Обчислити масу цукру та води у цьому розчині.
Варіант 5: Обчисліть масу гашеного вапна (Ca(OH)2), щоміститься в розчиніоб"ємом 600 мл з масовоючасткоюречовини 15%, якщойогогустина - 1, 1 г/мл.
Варіант 6: До розчинухлоридноїкислотиоб"ємом 120 мл з масовоючасткою 4% і густиною 1,02 г/мл, долили воду об"ємом 100мл. Яка масовачасткакислоти в утвореномурозчині?
|
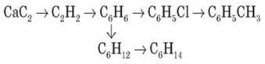
КОНТРОЛЬНА РОБОТА № 1 за темою "Періодичний закон і Періодична система хім. елементів Д.І. Менделєєва" |
|
1 рівень (3 бали) Варіант 1: Група - це...Скільки є груп? Як поділяються? Варіант 2: Сформулюйте Періодичний закон. Коли і ким був сформульований Періодичний закон? Варіант 3: Лужні метали:...........Характ-ка властивостей Натрію. Варіант 4: Період - це.....Сільки є періодів? Як поділяються? Варіант 5: Класифікація - це........Якою була перша спроба класифікації хім.елементів? Варіант 6: Галогени:..........Характеристика властивостей Хлору. Варіант 7: Інертні (благородні) гази:.......Характ-ка інертних газів. Що значає з латин."геліос"? Варіант 8: Ряд - це......... Як поділяються?
2 рівень (3 бали) Завдання (1, 5 бали) Охарактеризуйте хім. елементи за місцемположення у ПС: Варіант 1: №11, 13. Варіант 2: № 55, 14, Варіант 3: №, 22, 99 Варіант 4: № 30, 62 Варіант 5: № 88, 28.
Варіант 6: № 87, 7. Варіант 8: № 92, 12. За планом: №періоду (великий чималий); № групи (головначипобічна); №ряду (парнийчинепарний); з якимихім.елементамимежує?; Аr(Е)==?; протони (p), нейтрони (n), електрони (e). 2) Задача (1,5 бали) Варіант 1: Оксид I групимаєМr =62.Який цеелемент? Варіант 2: Оксид I групимаєМr = 94. Якийцеелемент? Варіант 3: Оксид I групиМr = 30. Якийцеелемент? Варіант 4: Оксид III групи. Мr= 70. Якийцеелемент? Варіант 5: Оксид IV групи. Мr = 44. Якийцеелемент? Варіант 6 : Оксид IV групи. Мr = 60. Якийцеелемент? Варіант 7: Оксид V групи. Мr = 108. Якийцеелемент? Bаріант 8 : Оксид V групи. Мr = 142. Якийцеелемент? 3 рівень (3 бали) Задача Варіант 1: ЕО2, W (O) = 53, 3%. E- ? Варіант 2: E2O3, W (O)= 47,05%. E- ? Варіант 3: Е2О5, W (O)=56,3%. Е- ? Варіант 4: Е2О3, W (O)= 68,57%. Е- ? Варіант 5: Е2О5, W (O)= 34,78%. E-? Варіант 6: ЕО2, W(E)=60,00%. Е-? Варіант 7: ЕО2, W(O)=21,23%. E-? Варіант 8: Е2О5, W(O)=56,3%. E-?
4 рівень ( 3 бали) Детально пояснити з точки зору розміщення хім. елементів у Періодичній системі та з точки зору будови атомів, як змінюються властивості на проміжках: Варіант 1: Li - F Варіант 2: Mg - CI Варіант 3: Al - P Варіант 4:Be - O Варіант 5:P - Ar Варіант 6: Ar - Sc Варіант 7: K- Ga Варіант 8: Mg - S |
|
КОНТРОЛЬНА РОБОТА 3 (семестрова1) ПО ТЕМІ «ХІМІЧНИЙ ЗВ»ЯЗОК.БУДОВА РЕЧОВИНИ» |
|
1 рівень (3бали) Варіант1 Хім.зв"зок- це.... Намал.схемуутвор.хім.зв"зку в молекулі Н2. (малюнок) Катіони - це.....Приклади Варіант2 Ковалентнийзв"язок - це....Приклади Охаректир-те атомнукристалічнугратку. Приклади. Хім.елемент з найвищоюелектронегативністю.......з найнижчою........ Варіант 3 Йоннийзв"язок - це....Приклади. Аніони - це...Приклади. Охаракт-те молекулярнукристал.гратку.Приклади. Варіант 4 Ступіньокиснення - це....Приклади. Електронегативність - це.... Охарактеризутейоннукристалічнугратку. Приклади. Варіант 5 Ковалентнийполярнийзв"язоквиникає..........Приклади. Кристалічнагратка (решітка) - це..... Катіони - це...Приклади. Варіант 6 Як змінюєтьсяелектронегативністьхім.елементіввперіодах?вгрупах? Ступіньокиснення Оксигену....Гідрогену.....простихречовин....... Хім.зв"язок - це..... 2 рівень (3 бали) Зданогоперелікуречовинвипишітьокремоформулиречовин з: -ковалентнимполярним; -ковалентнимнеполярним; -йоннимзв"язками. Варіант1: NO; O2; ZnCl2; NH3; N2; BaF2. Варіант 2: F2; H2O; NaCL; PH3; Cl2; CuBr2. Варіант 3: FeS; H2S;H2; CH4;CaCl2; Br2. Варіант4: N2O3; SiH4; Na2S; H2; FeCl3; O3. Варіант 5: H2Se; K2Se; I2; CО2; CaS; P4. Варіант 6: HgO; S8; LiCl; N2O3; H2; CCl4 2) Намалюйте схемибудовиатомів та йонівзапропонованих вам елементів. Варіант 1: Натрій; Сульфур Варіант 2:Магній; Хлор Варіант 3: Алюміній; Оксиген Варіант 4: Кальцій; Флуор Варіант 5: Калій; Бром Варіант 6: Цинк; Фосфор 3) Визначтеступеніокисненняатомів у сполуках Варіант 1: Mn2O3; MnO; MnO2; HMnO4;NaMnO4; Варіант 2:Fe2O3; FeO; Fe(OH)2; Fe; Na3FeO3; Варіант 3: P2O5; P2O3; O2; H3PO4; HPO3 Варіант 4: Cl2O; Cl2O7; HCl; CL2; HClO4 Варіант 5: SiH4; H2SiO3; SiO2; H2; Na2SiO3 Варіант 6: V2O5; V2O3, H3VO4; O3; AlVO4 3 рівекнь (3 бали) Скластиелектронні та графічніелектронніформули для речовин: Варіант1: H2; H2Se; NaBr Варіант 2: Cl2; H2O; BaCl2 Варіант 3: O2; CH4; KBr Варіант 4: N2; NH3; LiCl Варіант 5: I2; H2S; MgF2 Варіант 6:F2; PH3; AlCl3 Вказати тип хім.зв"язку. У речовини з ковалентним полярним зв"язком вказатихім. елементізбільшоюелектроне-гативністю. 4 РІВЕНЬ (3 БАЛИ) Пояснитимеханізмутворення молекул: а) бор трифториду; б) кальцій хлориду; в) натрійдигідрогенсульфіду. Вкажіть у даних молекулах речовин сумарну кількість спільних електронних пар.
|
|
КОНТРОЛЬНА РОБОТА 4 по темі "Кількістьречовини.Моль - одиницякількостіречовини" 8 клас |
|
1 РІВЕНЬ (3 бали) Варіант 1 Кількістьречовини - це.... Одиницівимірюваннякількостіречовини:.... Стала Авогадро дорівнює:..... Варіант 2 Молярнамасаречовин - це..... Молярнийоб"ємдорівнює:.... Відноснагустинагазів - це..... Варіант 3 Одиницівимірювання молярного об"єму:.....;одиниці вимірювання молярноїмаси:.... Сформулюйте закон Авогадро:....... Формула на обчисленнявідносноїгустинигазів:.... Варіант 4 Стала Авогадро дорівнює:..., позначається:...., одиниці вимірювання:............ Написатиформули ,щомістятьвеличини: "кількістьречовини", "молярнамаса", "масаречовини" Варіант 5 Молярнийоб"ємгазів - це.... Написативсіформули, щомістятьвеличини "число структурних частинок", "кількістьречовини", "стала Авогадро". Варіант 6 Моль - це..... Написативсіформули, щомістятьвеличини: "молярнийоб"єм", "кількістьречовини", об"єм газу".
2 РІВЕНЬ (3 БАЛИ) 1) Обчислитимолярнумасуречовин: Варіант 1:H2S, O2, CH4, N2 Варіант 2:O3, H2, C2H2, HCl Варіант 3:NH3, HF, F2, H2 Варіант 4:PH3, AsH3, Cl2, He Варіант 5:SiH4, N2, Ne, NH3 Варіант 6:F2, O3, HCl, PH3. 2) Обчислитивідноснугустинугазів, формулияких є у завданні 1 за повітрям. 3) Розв"язати задачу. Обчислити число молекул (N), масу(m) та об"єм(V) речовини, хім.формулаякоїпідкреслена у 1 завданні, якщодану речовинувзатокількістю 5 моль. 3 РІВЕНЬ (3 БАЛИ) Розв"язати задачу. Варіант 1: Якомуоб"єму та кількостіречовинивідповідає азот масою 5,6 г? Скільки молекул там міститься? Варіант 2: Яка маса і кількістьречовиникиснюоб"ємом 1,12 л? Скільки молекул кисню там міститься? Варіант 3: Яка маса й об'єм хлору кількістюречовини 0,5 моль? Скільки молекул хлору там міститься? Варіант 4: Якому об'єму та кількостіречовинивідповідає водень масою 10 г? Скільки молекул там міститься? Варіант 5: Яка маса й об'ємсульфур (IV) оксиду кількістю речовини 2 моль? Скільки молекул там міститься? Варіант 6: Якіймасі та кількостіречовинивідповідаєнітроген (IV) оксид об'ємом 8,96 л? Скільки молекул там міститься? 4 РІВЕНЬ (3 БАЛИ) Варіант 1: Варіант 2: Варіант 3: Варіант 4: Варіант 5: Варіант 6:
|
КОНТРОЛЬНА РОБОТА №1 по темі "Розчини" 9 клас1 рівень (3 бали)Варіант 1: Розчини це....Приклади.Класифікація розчинів: а).....б).....в)........Приклади.Розчинник - це......Варіант 2: Емульсії - це.......Приклади.Суспензії - це.......Приклади.Розчинність - це.......Варіант 3: Чинники, від яких залежить розчинність речовин:а)........б)........в)........г)........д)..........Кристалогідрати - це......Приклади.Формула на обчислення масової частки кристалізаційної води:...........Варіант 4: Криві розчинності - це.......Насичений розчин - це........Ненасичений розчин - це.........Варіант 5: Формула води:....Охарактеризуйте фізичні властивості води.Яку будову має молекула води ?(малюнок).Варіант 6: Охарактеризуйте водневий зв"язок.Масова частка розчиненої речовини - це.......Молярна концентрація - це.....Варіант 7 : Написати всі формули на обчислення масової частки розчиненої речовини (W).2 рівень (3 бали)1)Обчислити масову частку кристалізаційної води в кристалогідраті.(1,5 бали)2)Розв"яжіть задачу.(1,5 бали)Варіант 1:1)CuSO4* 5 H2O; 2)У воді масою 200 грам при температурі 20 градусів розчинили сіль масою 63,2 грами. Яка розчинність солі?Варіант 2:1)FeSO4*7 H2O2)У воді масою 150 грам при температурі 80 градусів розчинили 45 грам солі. Яка розчинність солі при даній температурі?Варіант 3:1)CaSO4*2H2O2)Розчинність солі при температурі 75 градусів - 11 грам. Яка маса розчиниться у воді масою 50 грам ?Варіант 4:1)Na2SO4*10H2O2) У воді масою 250 грам при температурі 90 градусів розчинили сіль масою 2, 15 грам.Яка розчинність солі при даній температурі?Варіант 5:1)Na2CO4*10H2O2)Розчинність солі при температурі 75 градусів - 65, 25 грам.Яку масу солі можна розчинити у воді масою 200 грам?Варіант 6:1)ZnSO4*7H2O2)Розчинність солі при температурі 20 градусів - 15 грам.Яку масу її можна розчинити при даній температурі у воді об"ємом 150 мл.Варіант 7:1)MgSO4*7H2O2)У воді масою 10 грам при температурі 75 градусів розчинили 5, 625 грам солі. Яка розчинність солі при даній температурі?3 рівень (3 бали) РОЗВ"ЯЗАТИ ЗАДАЧІВаріант 1:1)Розчинили сіль масою 50 грам у воді масою 450 грам. Яка масова частка солі в утвореному розчині?2)До розчину солі масою 250 грам з масовою часткою солі 20% долили воду об"ємом 150 мл. Яка масова частка в утвореному розчині?Варіант 2:1)У воді об"ємом 160 мл розчинили сіль масою 40 грам.Яка масова частка в утвореному розчині?2)Обчисліть масу солі , що міститься в розчині об"ємом 600мл з масовою часткою солі 0, 15, якщо його густина - 1, 1 г/мл.Варіант 3:1)Обчисліть масу солі в розчині масою 150 грам з масовою часткою 0,3.2)До розчину солі об"ємом 120 мл з масовою часткою кислоти 0, 04 (густина - 1, 02 г/мл) долили воду об"ємом 100мл. Яка масова частка солі?Варіант 4:1)Обчисліть масу солі, що міститься в розчині масою 300 грам з масовою часткою 0,2.2)До розчину масою 25 грам з масовою часткою солі 20% долили воду об"ємом 225мл.Яка масова частка в утвореному розчині?Варіант 5:1) )Обчисліть масу солі в розчині масою 200 грам з масовою часткою 30%.2)Обчисліть масу солі , що міститься в розчині об"ємом 360 мл з масовою часткою солі 25%, якщо його густина - 1, 1 г/мл.Варіант 6:1)У воді об"ємом 200 мл розчинили сіль масою 45 грам.Яка масова частка в утвореному розчині?2)До розчину солі масою 300 грам з масовою часткою солі 35 % долили воду об"ємом 150 мл. Яка масова частка в утвореному розчині?Варіант 7:1)Розчинили сіль масою 50 грам у воді масою 560 грам. Яка масова частка солі в утвореному розчині?2) Обчисліть масу солі , що міститься в розчині об"ємом 360 мл з масовою часткою солі 25%, якщо його густина - 1, 1 г/мл.4 рівень (3 бали)Яка маса розчину аргентум нітрату з масовою часткою AgNO3 ..............треба добавити до хлоридної кислоти об"ємом .............з масовою часткою HCL ............і густиною ............, щоб повністю осадити аргентум хлорид?Замість крапочок поставити дані (згідно свого варіанту).Варіант 1: 10%; 50мл; 12%; 1,06г/млВаріант 2: 20%; 100мл; 15%; 1,67г/млВаріант3: 25%; 120мл; 16%; 1,87 г/мл.Варіант 4: 20%; 150 мл; 14%;2,08 г/млВаріант 5: 15%; 200 мл; 20%; 1, 87 г/мл.Варіант 6: 16%; 210 мл; 15%; 1,034г/млВаріант 7: 25%; 190 мл; 15%; 1,06 г/мл.
|
КОНТРОЛЬНА РОБОТА 2 по темі: «EЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ» 9 клас |
|||||||||||||||||||||||||||||||||
|
1 РІВЕНЬ (3 БАЛИ) Варіант 1: Електроліти - це......Приклади. Намалюватималюнокдисоціаціїречовини з ковалентнимполярнимзв"язком ( хлоридна кислота). Ступіньдисоціації - це......... Варіант 2: Неелектроліти - це.....Приклади. Слабкіелектроліти - це......Приклади. Катіони - це...........Приклади. Варіант 3: Електролітичнадисоціація - це......... Намалюватималюнокдисоціаціїречовини з йоннимзв"язком (кухоннасіль). Аніони - це........Приклади. Варіант 4: Сильніелектроліти - це.......Приклади. Умовипроходженнянеоборотнихреакцій:а).....;б).........;в)............ Хто і коли дослідивявищеелектролітичноїдисоціації? Варіант 5: Реакціїйонногообміну - це ........... Гідратованійони - це.......... Речовини з яким типом хім.зв"язку не дисоціюють? Варіант 6: Електроліти - це.............Приклади Формула на обчисленняступеня дисоціації........... Рівнянняелектролітичноїдисоціації - це........
2 рівень ( 3 бали) 1) Скластирівнянняелектролітичноїдисоціації: Варіант1: H2SO4; Ba(OH)2; Na2SO4 Варіант 2:KOH; H3PO4; Na2CO3 Варіант 3:Cu(HSO4)2; H2SO3; NaOH Варіант 4: Fe(ОН)CL; Fe(OH)2; HCL Варіант 5:Pb(OH)2; H2СО3; Ca(OH)2 Варіант 6:H3AsO4; NaOH; Ca(H2PO4)2 2) Задача. Обчислитиступіньдисоціаціїелектроліта( у%), якщо: Варіант1: з кожноїтисячі 80 продисоціювали на йони; Варіант 2: з 250 молекул150 продисоціювали на йони; Варіант 3: з 60 молекул 45 продисоціювали на йони; Варіант 4: із 350 молекул 290 продисоціювали на цони; Варіант 5: ізтисячі 760 продисоціювали на йони; Варіант 6: із 30 молекул 5 продисоціювали на йони. Вкажіть, який цеелектроліт? 3) Вказатисильні та слабкіелектроліти: Варіант1:HNO3;NaOH; Ba(OH)2; H2O;CH3COOH Варіант 2:KOH; Cu(OH)2 ;H2SO4 ;H2CO3; LiOH Варіант 3:Mg(OH)2; H2S; H2SO4; NaCL; K2SO4 Варіант 4:CH3COOH; H2O; Fe(OH)3; HCL; NaOH Варіант 5: HNO3; HMnO4; Pb(OH)2; HCL; HF Варіант 6: H2CO3; Ba(OH)2; Ca3(PO4)2; HCL; H3AsO4
3 рівень (3 бали) Скластирекції йонногообміну. Вказатинеоборотнуреакцію. Варіант 1: а) натрій карбонат і хлоридна кислота б) калійнітрат і натрій хлорид Варіант 2: а) аргентумнітрат і натрій хлорид б) калійбромід і літійсульфід Варіант 3: а) кальцій хлорид і натрій карбонат б) кальцій хлорид і натрійнітрат Варіант 4: а) барій хлорид і натрій сульфат б) купрум (II) хлорид і барійнітрат Варіант 5: а) магній хлорид і аргентумнітрат б) літій фторид і магнійнітрат Варіант 6: а) натрійсульфіт і хлоридна кислота б) барійнітрат і калійбромід 2) За схемою скластиреакціїйонногообміну: Варіант1: H(+) + OH(-) = H2O Ba(2+) + SO4(-) = BaSO4 Варіант2: Ag(+) + CL(-) = AgCL 2H(+) + CO3(2-) = H2CO3 Варіант3: 2H(+) + SO4(2-) = H2O + SO2 Fe(2+) + 2OH(-) = Fe(OH)2 Варіант4: Ba(2+) + CO3(2-) =BaCO3 3Mg(2+) + 2PO4(3-) =Mg3(PO4)2 Варіант 5: 2Н(+) + S(2-) = H2S Cr(3+) +3OH(-) =Cr(OH)3 Варіант 6: Pb(2+) +S(2-) = PbS H(+) + OH(-)= H2O 4 рівень(3 бали) Розв"язатизадачі. Варіант 1: Під час взаємодіїкупрум (II) сульфату масою 3,2 грами з калійгідроксидомутворився осад. Обчислитимасукупрум (ЇЇ) гідроксиду. Варіант 2: Обчислитимасу осаду, якийутворюєтьсяпід час взаємодіїбарій хлориду масою 3,9 грам та натрій сульфату. Варіант 3: Обчислитиоб"єм газу, якийутворюєтьсяпід час взаємодіїкрейди (СаСО3) масою 10 грам з хлоридною кислотою. Варіант 4: Знайти, яка масасоліутворитьсяпід час взаємодіїнатрійгідроксидумасою 4 грами з хлоридною кисло-тою. Варіант 5: Знайтимасу осаду, якийвипадепід час взаємодіїкупрум (II) хлориду з калійгідроксидоммасою 2,76 грам. Варіант 6: Обчислити, якийоб"єм газу виділитьсяпід час взаємодіїї цинку хлориду з натрійсульфідоммасою 2, 62 грам.
КОНРОЛЬНА РОБОТА 5 по темі «ОКСИГЕНОВМІСНІ ОРГАНІЧНІ РЕЧОВИНИ» 9 клас 1 рівень (3 бали) Варіант 1:Спирти - це......Приклади. Заг.формулаальдегідів:... Охар-те фіз.власт. карб.одноосновних кислот. Варіант2:Альдегіди - це....Приклади. Заг.формуласпиртів:... Охар-те утвор. водневого зв"язкуміж молекулами спиртів (малюнок) Варіант 3:Карбонові кислоти - це....Приклади. Заг.формулакарбон.одноосновних кислот:... Охарак-те фіз. властспиртів. Варіант 4: Назвафункц. груписпиртів:....і формула..... Назвафункц. групиальдегідів:...і формула.... Назвафункц. групи карбонов. одноосновн. кислот:...і формула..... Варіант 5:Назви спиртівпоходятьвідназви... іздодаваннямсуфікса.....Приклад. Назви альдегідів походятьвідназви... іздодаваннямсуфікса.......Приклад. Назви карб. одноосн. кислот походятьвідназви... іздодаваннямсуфікса.......Приклад. Варіант 6: Написатихім.формулу (отруйного!) спирту, датиназву. Написатикислотнийзалишок ацетат.... Написатиназву C2H5O-(етилового спирту)...... 2 рівень ( 3 бали ) 1 Складітьхімічну (молекулярну, структурну, графічну та електронну) формулиорганічної речовини: Варіант 1: пентаналю Варіант 2: гексанолу Варіант 3: бутановоїкислоти Варіант 4: бутаналю Варіант 5: пентанолу Варіант 6:гексановоїкислоти 2.Серед зазначеногоперелікуречовинвипишітьокремохім.формулиспиртів. альдегідів, карбоновихречовин: Варіант 1: CH4, CH3OH,C2H2, C4H10O, CH3COOH, C2H5OH, CH3-COH, C2H5COH, C6H6,C7H15COH, C3H6,CH3COOH. Варіант 2: HCOOH, HCOH, C2H5OH, C3H7COOH, C6H5OH, C2H6, C4H9COOH,C3H7COH,C6H6,C2H2, C3H7OH Варіант 3: CH3-COOH,CH3COH,C17H35COOH,C3H6,C3H5(OH)3,CH4,CH3 - O - CH3,C5H11OH,HCOOH,C4H9OH,C2H2, O2 Варіант 4: CH4, CH3OH,C2H2, C4H10O, CH3COOH,C2H6, C4H9COOH,C3H7COH,C6H6,C2H2, C3H7OH, C6H11OH Варіант 5: CH3-COOH,CH3COH,C17H35COOH,C3H6,C3H5(OH)3,C6H5OH, C2H6, C4H9COOH,C3H7COH,C6H6,C2H2, C3H7OH Варіант 6: C4H10O, CH3COOH,C2H6, C4H9COOH,C3H7COH,CH4, CH3OH,C2H2, C4H10O, CH3COOH, C2H5OH, CH3-COH. 3.Складіть формулу насиченого одноатомного спирту, дайте назву та обчислітьмасовучастку Оксигену у формулі (%): Варіант 1:До складу входить 14 атомівГідрогену. Варіант 2:До складу входить 7 атомів Карбону. Варіант 3:До складу входить 3 атоми Карбону. Варіант 4:До складу входить 22 атомиГідрогену. Варіант 5: До складу входить 9 атомів Карбону. Варіант 6:До складу входить 18 атомівГідрогену. 3 рівень (3 бали ) 1. Напишітьрівнянняреакцій, що лежать в основі схем: Варіант 1: CH4 - C2H2 - C2H4 - C2H5OH - C2H5ONa Варіант 2: CaC2 - C2H2 - C2H4 - C2H5OH - CH3COH Варіант 3:CH3OH - HCOH - CH3COOH - CH3COONa Варіант 4: C2H6 - C2H5Br - C2H5OH - C2H5(O)C2H5 Варіант 5: C - CaC2 - C2H2 - CH3COH - CH3CH2OH Варіант 6: C2H4 - CH3COH - CH3COOH - CO2 2. Розв"язатизадачу: Варіант 1: Доскладуорганічноїречовинивходять:Карбон-52,17%,Гідроген-13,04% іОксиген.Густинапарицієїречовинизагелієм -11,5.Обчислітьмолекулярнуформулуречовини. Варіант 2:Приготувалирозчинформалінумасою 200г з масовоючасткоюметаналю 0,4. Яку масу води і обємметаналюпотрібновзяти? Варіант 3: Масовічасткиелементівускладіорганічноїречовинистановлять: Карбон-54,54%, Гідроген-9,1%; Оксиген-36,36%.Густина парів за киснем- 2,75. Знайдіть формулу речовини.Напишітьїїструктурну формулу. Варіант 4: Відноснагустина пари спирту за воднем - 44.До його складу входять: Карбон-68,18%,Гідроген-13,64% і Оксиген. Обчислітьмолекулярну формулу. Варіант 5: Етанальмасою 220 г окиснилиповітрямоб'ємом 280 л. Яка маса продукту реакціїутворилася? Варіант 6: На магніймасою 16,8 г подіялинадлишкометановоїкислоти.Якийоб'єм газу виділився? 4 рівень (3 бали) Варіант 1: a) CH3COOH + Mg = b) C2H5COOH +NaOH = c) CH3COH+Ag2O= Етанову кислоту кількістюречовини 0,3 моль повністюнейтралізувалирозчиномнатрійгідроксиду.Якамасасоліутворилася? Варіант 2: a) C2H5COH + Cu(OH)2= b) CH3COOH+Ca(OH)2= c) C2H5OH+ Na= Бутаналькількістюречовини 0,4 моль окисниликиснем у присутностікаталізатора. Яка маса продукту реакціїутворилася? Варіант 3: a) C2H5COOH + Na2CO3= b) C3H7OH + HBr= c) C4H9COH+ H2= При нагріванніетаналю з купрум (ІІ) гідроксидомутвориласяречовиначервоно-моркв"яногокольору масою 1,44 грами. Яка масаетаналю вступила в реакцію ? Варіант 4: a) C2H5OH + CH3OH= b) C3H7COH+Ag2O= c) CH3COOH + CaCO3= Етанолпрореагував з гідрогенбромідом. Утворивсябромоетанмасою 1,09 грам. Яка масаетанолу вступила у взаємодію ? Варіант 5: a) CH3COOH + Mg = b) C2H5COOH +NaOH = c) C4H9COH+ H2= Етановукислотукількістюречовини 12,3 мольповністюнейтралізувалирозчином калійгідроксиду. Якамасасоліутворилася? Варіант 6: a) C2H5COH + Cu(OH)2= b) CH3COOH+Ca(OH)2= с) C3H7OH + HBr= Який об"ємводню (н.у.) виділитьсяпід час взаємодіїнатрію масою 2,3 грами з пропанолом? КОНТРОЛЬНА РОБОТА 1 по темі «НЕМЕТАЛИ ТА ЇХНІ СПОЛУКИ» 10 КЛАС Варіант І 1. Формула вищого оксиду елементівпідгрупи Оксигену: а) Е2O3; б) EO2; в) EO3; г) E2O5. 2. Озон за фізичнимивластивостями: а) газ жовтогокольору без запаху, розчинний у воді; б) безбарвний газ ізрізким запахом, розчинний у воді, в) блакитний газ із запахом свіжості, розчинний у воді. 3. АлотропнимивидозмінамиСульфуру є сірки: а) червона й чорна; б) жовта й коричнева; в) кристалічна й пластична. 4. Кількістьзв’язківміж атомами Оксигенувмолекулікисню: а) один; б) два; в) три. 5. Найбільшакількістьозонувприродіміститься: а) у повітрі; б) в озоновому шарі; в) у воді. 6. Формула вищогогідроксидуелементівпідгрупиСульфуру: а) HEO3; б) H2EO3; в) HEO4; г) H2EO4.
7. Здійсніть схему перетворень: 8. Реакцію 5 запишіть у іонно-молекулярнійформі. 9. До розчинусульфатноїкислотимасою 4,9 г додали кальцій карбонат масою 10 г. Обчислітьоб’ємвуглекислого газу (н. у.), щоутворився в результатіреакції. 10. Нагріли суміш порошків заліза масою 5,88 грам з масовою часткою домішок 0, 05 з сіркою масою 4 грами. Яка маса ферум (ІІ) сульфіду утворилася?
Варіант ІІ 1. Розподіл електронів на зовнішньому рівні атомів елементів підгрупи Оксигену: а) s2 p3 d1; б) s2 p4 d0; в) s1 p3 d2. 2. Виберітьфізичнівластивостісірчистого газу: а) газ; б) газ без запаху; в) безбарвний газ без запаху; г) газ з різким запахом,розчинний у воді. 3. До фізичнихвластивостейсульфатноїкислоти належать такі: а) газ; б) масляниста рідина; в) відсутністькольору; г) жовтийколір; д) відсутність запаху; е) слабкий запах. 4. Установітьвідповідність: Формула Назва 1. SO2 А. Сульфатна кислота 2. H2SO4 Б. Сульфур( IV ) оксид 3. SO3 В. Сульфур( VI ) оксид 5. Сіркавприродіпоширена: а) лишеувільномустані; б) лише у зв’язаномустані; в) і увільному, і у зв’язаному станах. 6. Характерними ступенями окисненняелементівпідгрупиCульфуру є: а) +4, +6, 0, —2; б) +3, +5, —1, —2, —3; в) +4, +5, -3.
7. Здійсніть схему перетворень: 8. Реакцію 1 запишіть у іонно-молекулярнійформі. 9. Обчислітьоб’ємводню (н. у.), щовиділиться в результатівзаємодіїрозчинусульфатноїкислотимасою 17,6 г з алюмінієммасою 2,7 г. 10. Урезультатівзаємодіїкальційгідроксидумасою 37 г з амоній сульфатом одержали 15 г амоніаку (NH3). Обчислітьмасовучасткувиходуамоніаку.
Варіант ІІІ 1. Характерними ступенями окисненняелементівпідгрупиCульфуру є: а) +1, +2, +3, +5, -1, —2, -3; б) +3, +5, -1, —2, -3; в) +4, +6, -2, 0. 2. Сульфур(IV) оксид за хімічнимивластивостяминалежить до групи: а) основних; б) кислотних; в) амфотерних. 3. Сірка у природіпоширена у стані: а) вільному; б) зв’язаному; в) і у вільному, і у зв’язаному. 4. Кисеньзастосовується: а) як окисник в хім.промисловості; б) для виготовленняіграшок; в) для виготовленнясірників. 5. Природною сполукоюОксигену є: а) кисень; б) халцедон; в) пірит; г) озон. 6. До фізичнихвластивостейсульфур(VI) оксиду належать такі: а) рідина; б) газ; в) відсутність запаху; г) запах; д) розчинний у воді; е) нерозчинний у воді. 7. Напишітьрівнянняреакцій для здійсненнясхемиперетворень: FeS – SO2 – SO3 – H2SO4 – CaSO4 8. Реакцію4запишіть у іонно-молекулярнійформі. 9. Обчислітьоб’ємсірчистого газу (н. у.), щовиділиться в результатівзаємодіїсіркимасою 9,6 г з киснем об’ємом 4,48 л (н. у.). 10. До розчину ферум (ІІІ) сульфату масою 100 грам з масовою часткою речовини 40 % долили розчин калій гідроксиду масою 42 грами. Яка маса речовини, що утворила бурий осад? Варіант ІV
а) явище існування різних хімічних елементів у вигляді кількох простих речовин, що подібні за будовою; б) явище існування одного й того самого хімічного елемента у вигляді кількох простих речовин, що подібні за будовою та властивостями; в) явище існування одного й того самого хімічного елемента у вигляді однієї простою речовини, що подібні за будовою та властивостями. 2. Сульфур(IV) оксид за хімічнимивластивостяминалежитьдо: а) основнийі солетворний; б) кислотний і несолетворний; в) кислотний і солетворний. 3. Сірка у природіпоширена у стані: а) вільному; б) зв’язаному; в) і у вільному, і у зв’язаному. 4. Формула леткої водневої сполуки для атома Сульфуру: а) H2S; б)SH4; в) SH3; г) HS. 5. У повітрі масова частка (у %) кисню: а) 28%; б) 19%; в) 78%; г) 21%. 6. Характерними ступенями окисненняелементівпідгрупиCульфуру є: а) +4, +6, 0, —2; б) +3, +5, —1, —2, —3; в) +4, +5, -3.
7.Здійснітьсхему перетворень: 8. Реакцію1запишіть у іонно-молекулярнійформі. 9. Обчислітьоб’ємводню (н. у.), щовиділиться в результатівзаємодіїрозчинусульфатноїкислотимасою 17,6 г з алюмінієммасою 2,7 г. 10. Урезультатівзаємодіїкальційгідроксидумасою 37 г з амоній сульфатом одержали 15 г амоніаку (NH3). Обчислітьмасовучасткувиходуамоніаку.
|
|||||||||||||||||||||||||||||||||
1


про публікацію авторської розробки
Додати розробку