Матеріали з хімії до уроку на тему "Білки", 10 клас
З історії виникнення білків
Білки були віділені в окремий клас біологічних молекул у XVIII столітті в результаті робіт французького хіміка Антуана де Фуркруа та інших вчених, в яких було відмічено властивість білків коагулювати при нагріванні або дією кислот. У той час були досліджені такі білки, як альбумін з яєчних білків,
Білки були вперше описані шведським хіміком Єнсом Якобом Берцеліусом в 1838 році, який і дав їм назву протеїни, від грец. πρώτα — «першорядної важливості».
Білки були вперше описані шведським хіміком Єнсом Якобом Берцеліусом в 1838 році, який і дав їм назву протеїни, від грец. πρώτα — «першорядної важливості».
На початку XX-го століття німецький хімік Еміль Фішер експериментально довів, що білки побудовані із залишків амінокислот, сполучених пептидними зв'язками. Проте, їх центральна роль в життєдіяльності всіх живих організмів була виявлена лише у 1926 році, коли Джеймс Самнер показав, що фермент уреаза також є білком.
Секвенування першого білка — інсуліну, тобто визначення його амінокислотної послідовності, принесло Фредерику Сенгеру Нобелівську премію з хімії 1958 року. Перші тривимірні структури білків гемоглобіну і міоглобіну були отримані за допомогою рентгеноструктурного аналізу, за що автори методу, Макс Перуц і Джон Кендрю, отримали Нобелівську премію з хімії 1962 року.
Щодо українських вчених, то І. Я. Горбачевський довів експериментально , шо білки складаються з амінокислот.
Хімічний склад білка
До складу білка входять наступні елементи
- До складу білка входять наступні елементи
- С, Н, О, N, S, P, Fe.
- Ферум у гемоглобіні крові , Фосфор у казеїні молока….
- Масова частка елементів:
- С – 50% - 55%
- О – 19% - 24%
- Н – 6,5% - 7,3%
- N – 15% – 19%
- S – 0,3% - 2,5%
- P – 0,1% - 2%
Розмір кожної амінокислоти близько 0,3 нм,
- Розмір кожної амінокислоти близько 0,3 нм,
- Білок, що складається з багатьох амінокислотних залишків, повинен становити собою довгу нитку
- Розміри молекул білків значно менші
- Макромолекули білків мають форму компактних кульок (глобул) або витягнутих структур (фібрил)
- Поліпептидний ланцюг якимось чином сплетений, утворюючи клубок або пучок «ниток»
- Він скручується упорядковано, для кожного білка - певним чином
Структура білків
Окремі амінокислоти з’єднуються між собою й утворюють ланцюг, який набуває певної просторової структури: спіральної, складчастої, тощо, яка, в свою чергу складає у тривимірну структуру. Ця структура може бути лише однією із субодиниць складного білка. Кожен білок має свою форму, яка залежить від його просторової структури.

Олександр Якович Данилевський (1838 – 1923 р. р.)
вивчав структуру білків, довів наявність пептидного зв’язку.
Розрізняють такі структури білка:
Первинна структура білка представлена поліпептидним ланцюгом. У цій структурі всі зв`язки між амінокислотами ковалентні, а отже, міцні. (мал.2, а)
Вторинна структура білка - це спосіб упакування первинної структури в альфа-спіраль або бета-шар. Альфа-спіраль виникає в результаті утворення водневих зв`язків між групами -СО- та -NH, розташованих на різних витках спіралі. (мал.2, б) Бета-шар утворюється в результаті формування водневих зв`язків між СО-групами одного поліпептидного ланцюга та NH-групами іншого поліпептидного ланцюга (мал.2, в)
Третинна структура - це спосіб упакування альфа-спіралі у просторову глобулу. Утворюється завдяки додатковим водневим зв`язкам, гідрофільно-гідрофобним взаємодіям та ковалентним дисульфід ним зв`язкам -S-S-, які виникають між двома молекулами цистеїну (мал.2, г).
Четвертинна структура - спосіб спільного упакування декількох поліпептидних ланцюгів (мал.2, д).
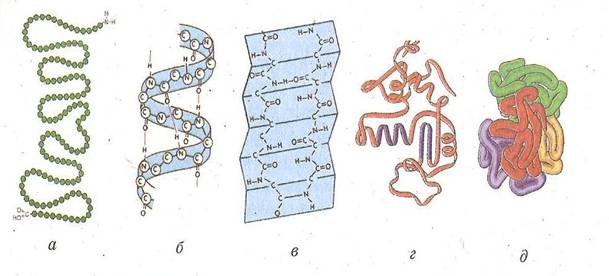
Мал. 2
Рівні організації білкової молекули: первинна структура (а); вторинна структура: б - альфа-спіраль, в - бета-шар; третинна структура (г); четвертинна (д)
Хімічні властивості білків
1. Гідроліз білків. Найважливішою властивістю білків є здатність їх до гідролізу. Гідроліз – розпад до амінокислот під дією ферментів в живих організмах або при нагріванні з розчинами кислот чи лугів.
2. Денатурація – порушення вторинної, третинної структури білка під впливом деяких факторів: дії сильних кислот й лугів, етанолу, солей важких металів, нагрівання, радіації, механічного впливу тощо.
3. Розклад. При сильному нагріванні (горінні, гнитті) відбувається повне руйнування білкових молекул й виділення летких продуктів, які мають запах паленого пір’я.
4. Амфотерність – взаємодія з кислотами й лугами з утворенням солей.
Наявність білків можна виявити за допомогою кольорових реакцій на білки. Біуретова реакція виявляє наявність у білку пептидного зв’язку. Ксантопротеїнова реакція дає можливість виявити в молекулах білків циклічні амінокислоти, які містять бензольне ядро-фенілаланін, тирозин й триптофан. Під впливом нітратної кислоти відбувається нітрування бензольного кільця амінокислот з утворенням нітросполук (динітротирозин) жовтого кольору. Внаслідок дії лугу утворюється натрієва сіль динітротирозину оранжевого кольору.
Лабораторний дослід 14. Кольорові реакції на білки
Дослід 1. Біуретова реакція
Налийте у пробірку розчин білка об’ємом 1-2 мл й добавте таку саму кількість лугу та 2-3 краплі розчину купрум (II) сульфату. Суміш енергійно збовтайте. Розчин набуде синьо-фіолетового або рожево-фіолетового забарвлення.
Дослід 2. Ксантопротеїнова реакція
Налийте у пробірку розчин білка об’ємом 1-2 мл, добавте концентровану нітратну кислоту об’ємом 0,5-1мл й обережно нагрійте. Осад забарвлюється в жовтий колір. Після охолодження по краплях добавте розчин лугу до появи оранжевого забарвлення.
Денатурація - це порушення природної структури білка. Якщо порушуються всі структури білка, включаючи первинну, така денатурація називається необоротною.
До денатурації призводить дія кислот, лугів та високих температур.
Білки також денатурують під дією важких металів, спиртів та інших органічних розчинників.
Ренатурація - це відновлення структури білка на початковій стадії руйнування.
Для допитливих
♦ Якщо в організмі не було б ферментів, невдовзі ми померли б з голоду, адже тоді звичайний процес перетравлення обіду тривав би 50 років;
♦ Білки є необхідною складовою частиною раціону. В організмі, в результаті гідролізу, з білків утворюються амінокислоти, які використовуються на синтез білка тіла даного організму. У результаті розкладу білка виділяється теплота, необхідна для виконання роботи та підтримання температури тіла.
♦ Світовий дефіцит білка складає близько 20 млн т на рік, тому вчені пропонують:
а) насіння деяких видів тютюну застосовувати як корм для тварин, оскільки воно багате на білок й не містить нікотину;
б) англійські вчені навчилися добувати штучне молоко із рослин (соєве молоко), а в США синтезована м’ясоподібна речовина з сої;
в) вихідною сировиною для синтезу білка можуть служити: торф, вуглеводні нафти й газу. Насичені вуглеводні хімічно пасивні, але деякі мікроорганізми на них ростуть дуже швидко, тому що здатні окиснити алкани. Якщо б вони переробили 73 млрд. м3 природного газу, то це забезпечило б річну потребу білка населення планети. Мікробна біомаса із метану містить 60-70% білка необхідного організму. Біомаса на 600 м3 парафінів нафти подвоюється за 1 годину й може вирости до еквівалентної м’ясної продукції стада в 100 тис. голів.
♦ Білок курячого яйця має деякі бактерицидні властивості, тому японські вчені запропонували розчином білка в дистильованій воді з желатином покривати м’ясо. Утворена після висихання плівка не лише не пропускає вологу, але й зберігає м’ясо від гниття.
♦ Старіння людини викликається зміною у білках. Тривалість життя запрограмовано в ядрі клітини (до 110-115 років). За 60-70 років організм людини близько 200 разів поновлює свої білки із амінокислот білків їжі. Очевидно, чим кращий «будівельний матеріал», тим старіння наступить пізніше. Довготривале харчування одноманітною їжею призводить до захворювань. При порушенні обміну білка виникають такі захворювання як порфінурія (утворення темно-червоних пігментів в шкірі), подагра (відкладання солей в сухожиллях дрібних суглобів рук, ніг).


про публікацію авторської розробки
Додати розробку
