Методичка з теми: Властивості газів.
Дана методичка допоможе учням узагальнити матеріал з теми "Основи молекулярно-кінетичної теорії" та опрацювати його самим-дистанційно, за необхідністю. До кожного конспекта додаються приклади розв`язаних задач, та задач для самостійного розв`язання
Основи молекулярно-кінетичної теорії
- Всі речовини в природі складаються з молекул і атомів
- Молекули і атоми всіх речовин перебувають у безперервному хаотичному русі
- Між молекулами всіх речовин діють сили притягання й відштовхування
Броунівський рух – це хаотичний рух дрібних частинок твердої речовини під ударами молекул рідини чи газу, у яких ці частинки містяться.
Дифузія речовин – це явище проникнення молекул однієї речовини між молекулами іншої речовини внаслідок їх взаємодії. Буває дифузія вимушена і не вимушена. З підвищенням температури процес дифузії прискорюється.
Осмос – це різновид дифузії, взаємне проникнення речовин крізь пористі перегородки.
Ідеальний газ – це газ, взаємодією між молекулами у якому можна знехтувати.
Гази: сили притягання і відштовхування дуже малі, дифузія проходе швидко, не зберігають форму і об’єм, молекули рухаються хаотично.
Рідини: сили притягання малі, а відштовхування великі, дифузія проходе повільно, зберігають наданий їм об’єм але не зберігають форму, їх молекули коливаються навколо нестійкого положення рівноваги.
Тверді тіла: сили притягання і відштовхування великі, на дифузію потрібні роки, зберігають форму і об’єм, молекули коливаються навколо положення рівноваги.
Відносна молекулярна маса Мr – це відношення маси молекули до 1/12 маси атома Карбону.
Відносна атомна маса Аr - це 1/12 маси атома Карбону.
1а.о.м. = 1/12mc = 1,66x•10-27кг
Молем називається кількість речовини, яка містить стільки ж молекул (атомів), скільки їх міститься в 12г вуглецю.
Молярна маса М – це маса одного моля речовини.
М = Мr •10-3кг/моль
NА = 6,02•1023 1/моль – стала Авогадро (показує, що в одному молі будь-якої речовини міститься 6,02•1023 молекул.
mo – маса однієї молекули
N – кількість молекул
ʋ - кількість речовини
N = m/ mo mo = M/ NА M = mo • NА
ʋ = N/ NА = m/ mo • NА = m/M
n = N/V[1/м3] – концентрація молекул (кількість молекул в одиниці об’єму)
p = 1/3•ƍῡ2 = 2/3 EK•n= nkT [Па] – тиск газів (основне рівняння МКТ ідеального газу)
ῡ - середня квадратична швидкість; ƍ = m/V – густина речовини
EK = mo ῡ2/2= 3/2kT – кінетична енергія
Теплова рівновага – це стан, за якого всі макроскопічні параметри залишаються скільки завгодно довго незмінними.
Температура - це міра кінетичної енергії теплового руху молекул.
Т = t + 273 [K](Кельвін) – зв'язок між температурою за шкалами Кельвіна та Цельсія
Т = 0К – абсолютний нуль температури, за якого припиняється тепловий рух молекул
k = 1,38•10-23 Дж/К – стала Больцмана
R = k• NА = 6,02•1023 •1,38•10-23 = 8,31Дж/моль•К – універсальна газова стала
pV = mRT/M – рівняння Менделєєва-Клайперона
p1V1 = p2V2 - рівняння Клайперона
T1 T2
Ізопроцеси – це процеси, за яких один із макроскопічних параметрів – температура, тиск або об’єм – залишаються постійними.
Ізотермічний процес (Бойля-Маріотта) – це процес, який відбувається за постійної температури.
T = const, p1 = V2 p1V1 = p2V2
p2 V1
Ізобарний процес (Гей-Люссака) - це процес, який відбувається за постійного тиску.
p = const, V1 = V2 V1 = T1
T1 T2 V2 T2
Ізохорний процес (Шарля) - це процес, який відбувається за постійного об’єму.
V = const, p1 = p2 p1 = T1
T1 T2 p2 T2
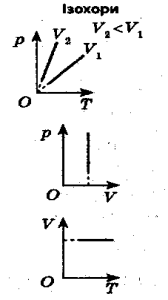
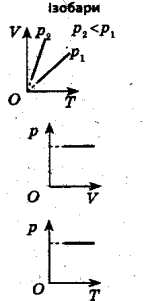
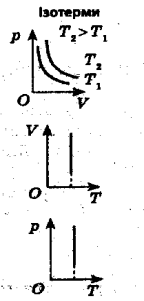
Приклади розв’язування задач

4. Визначте тиск, за якого 1 м3 газу з температурою 60° містить 2,4•1026 молекул.

5. Газ міститься в закритому балоні за температури 294 К і тиску 810 кПа. За якої температури тиск газу дорівнюватиме 1,12 МПа?

6. Газ, який має температуру 306 К, охолоджується на 32 К. При цьому об'єм газу зменшуєтьря на 24 дм2. Який початковий об'єм даної маси газу? Тиск газу вважати постійним.
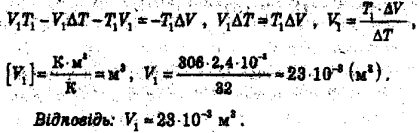
7. Під час ізотермічного стиснення об'єм газу зменшився на 5 л, а тиск збільшився в 3 рази. Яким був початковий об'єм газу?

8. Побудуйте графік даного процесу (рис. 1, а) в координатах р, V і V, Т (m = const).
Розв'язання
Аналіз процесу:
1) 1 - 2: р = const, від точки 1 до точки 2 температура зменшується;
2) 2 - 3: T=const, від точки 2 до точки З тиск збільшується, температура збільшується;
3) процес незамкнений.
а б в
Рис. 1
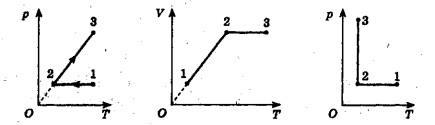
9. Побудуйте графік даного процесу (рис. 2, а) в координатах р, Т і V, Т (m = const).
Розв'язання
Авалі»процесу:
1) 1-2: T = const, від точки 1 до точки 2 тиск зменшується; об'єм зростає;
2) 2-3: p = соnst, від точки 2 до точки 3 об'єм зменшується;
3) 3-4: V = const , тиск збільшується;
 4) процес замкнений.
4) процес замкнений.
а б в
Рис. 2
Завдання для самостійного виконання
3.1 Визначити відносну молекулярну масу О2 , СН4, Н2S.
3.2 Визначити масу молекули Н2SO4.
3.3 З відкритої склянки за 20 діб випарувалась вода масою 200г. Скільки молекул випарувалось за 1 с?
3.4 Яка кількість речовини міститься в мідному дискові масою 3кг?
3.5 Який об’єм займуть 200 моль срібла?
3.6 В басейн глибиною 2 м і площею 12 м2 кинули кристалики мідного купоросу масою 200 г. Через деякий час з басейну взяли 1 л води. Скільки іонів міді буде в посудині об’ємом 1 л?
3.7 Визначити масу однієї молекули води.
3.8 Як зміниться тиск ідеального газу, якщо при незмінній концентрації молекул середня кінетична енергія молекул збільшиться у 3 рази?
3.9 Який тиск газу, якщо середня квадратична швидкість руху його молекул 300 м/с, а його густина 0,18 кг/м3
3.10 Чому дорівнює кількість молекул газу в одиниці об’єму, якщо його тиск дорівнює 400000 Па,а середня кінетична енергія поступального руху молекули становить 3пДж?
3.11 Визначте середню кінетичну енергію поступального руху молекул газів повітря при тискові 100 кПа. Концентрація молекул повітря 2500Е 1/м3.
3.12 Чому дорівнює середня кінетична енергія хаотичного руху молекул аргону, якщо 2 кг його, знаходячись у посудині об’ємом 2м3, виявляють тиск 300000 Па (молярна маса аргону 0,04 кг/моль)?
3.13 В посудині знаходиться газ при температурі 273 К. Визначити середню кінетичну енергію хаотичного руху молекул газу.
3.14 Яка густина вуглекислого газу, якщо його температура 27◦С, а тиск в балоні 10000000 Па?
3.15 Скільки молекул повітря виходить з кімнати об’ємом 120 м3 при збільшенні температури від 15 до 25 ◦С? Атмосферний тиск 100000 Па.
3.16 При ізохорному охолодженні ідеального газу, взятого при температурі 480 К, його тиск зменшився в 1,5 раз. Яка кінцева температура газу.
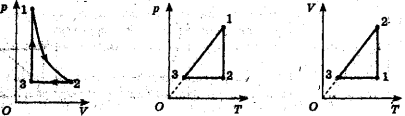
3.17 Порівняти тиск газу в точках 1 і 2 (рис. 3). Маса газу постійна.
3.18 Побудувати графік процесу, заданого на рис. 4, в координатах р, Т і V, Т (m = const).
3.19 Побудувати графік процесу, заданого на рис. 5, в координатах р, Т і р, V (m=const).
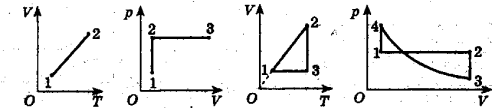 3.20 Побудувати графік процесу, заданого на рис. 6, в координатах р, Т і V, Т (m = const).
3.20 Побудувати графік процесу, заданого на рис. 6, в координатах р, Т і V, Т (m = const).
Рис. 3 Рис. 4 Рис. 5 Рис. 6


про публікацію авторської розробки
Додати розробку
