Методична розробка : АЛГОРИТМИ РОЗВ’ЯЗУВАННЯ ЗАДАЧ З ОРГАНІЧНОЇ ХІМІЇ
Опорний заклад освіти « Новозбур’ївська школа №1»
АЛГОРИТМИ РОЗВ’ЯЗУВАННЯ ЗАДАЧ З ОРГАНІЧНОЇ ХІМІЇ
Колодій Любов Володимирівна
вчитель хімії ОЗО «Новозбур’ївська школа №1» Голопристанського району Херсонської області.
2019 р.
Розв’язування розрахункових задач з хімії - одна зі складових хімічної освіти поряд з вивченням і засвоєнням теоретичного матеріалу та опануванням технікою експерименту. Уведення задач в навчальний процес дає змогу реалізувати такі дидактичні принципи навчання: забезпечення самостійності й активності учнів, досягнення єдності знань і умінь ; формування компетентностей учнів.
У ході розв’язування задач з хімії забезпечується вироблення оптимальної методики підходу до теоретичного обґрунтування умови задачі єдність навчання, розвитку виховання учнів; закріплення правил, термінів, законів, рівнянь; осмислення зв’язку фізичних величин, політехнічну підготовку знань учнів; конкретизація, систематизація, зміцнення і перевірка знань учнів; поєднання теорії з практикою, вміння втілювати свої знання у життя; розвиток логічного мислення, активізація розумової діяльності, виховання ініціативності, самостійності,уважності; ілюстрація хімічних закономірностей, принципів хімічної технології, продуктивності апаратів, якості та виходу готового продукту.
Розрахункові задачі відіграють значну роль в організації пошукових ситуацій, необхідних у проблемному навчанні, а також у здійсненні перевірки знань учнів і закріпленні засвоєного матеріалу.
Навчальною програмою з хімії, яка розроблена на основі положень Державного стандарту базової та повної середньої освіти, передбачається вивчення найважливіших органічних сполук в 9 та 11класах.
З метою кращого засвоєння теоретичного матеріалу в програмі вивчення курсу «Органічна хімія», доцільно використовувати розрахункові задачі на виведення молекулярних формул органічних речовин та типових розрахункових задач.
Навчитися швидко і правильно розв’язувати задачі можна використовуючи певні алгоритми та основні хімічні і фізичні властивості речовин.
Для формування основних умінь та навичок самостійного і раціонального розв’язування задач, пропонується систематизувати їх по вихідним даним і алгоритмам розв’язання.
Пропоную приклади розв’язування типових задач та приклади розв’язування задач на виведення формули органічних речовин:
- За густиною та відносною густиною;
- За масовими частками;
- За масами, об’ємами або кількістю речовини продуктів згорання;
- За характерними хімічними властивостями речовин;
- За об’ємними відношеннями газів;
- За законом збереження маси речовини;
- За рівнянням стану ідеальних газів.
АЛГОРИТМИ РОЗВ’ЯЗУВАННЯ ЗАДАЧ НА ВСТАНОВЛЕННЯ ФОРМУЛ ОРГАНІЧНИХ СПОЛУК
І. Виведення молекулярної форми відомого класу органічних сполук за відносною густиною
Приклад
Відносна густина пари алкану за киснем дорівнює 3,563. Визначте формулу цього алкану і назвіть його.
![]() Дано:
Дано:
СnH2n+2 Mr(CnH2n+2)= 12n+2n+2
D(CnH2n+2)О2= 3,563 1. Обчислимо молярну масу алкану:
![]() СnH2n+2 - ? M(CnH2n+2) = D(CnH2n+2)пов
СnH2n+2 - ? M(CnH2n+2) = D(CnH2n+2)пов![]() Mпов;
Mпов;
M(О2)=32г/моль M(CnH2n+2) = 3,931 ![]() 32 г/моль = 114 г/моль
32 г/моль = 114 г/моль
2. Обчислимо число атомів Карбону в алкані:
114= 12n+2n+2; 14n = 112; ![]() ; С8Н18
; С8Н18
Відповідь: Формула сполуки С8Н18 - октан.
ІІ. Виведення молекулярної формули за відомими масовими частками елементів
Приклад
Виведіть молекулярну формулу вуглеводню, масова частка Карбону в якому становить 82, 75%, а Гідрогену 17,25%. Відносна густина пари цього вуглеводню за повітрям дорівнює 2.
![]() Дано:
Дано:
ω(С) = 82,75% 1. Обчислимо молярну масу вуглеводню:
ω(Н) = 17,25% ![]()
![]() D(CxHy)пов = 2 2. Виводимо алгоритм для встановлення кількості атомів Карбону та Гідрогену:
D(CxHy)пов = 2 2. Виводимо алгоритм для встановлення кількості атомів Карбону та Гідрогену:
CxHy - ? ![]()
Mпов = 29 г/моль ![]()
3. Обчислюємо число атомів Карбону і Гідрогену у вуглеводні (для розрахунків відсотки переводимо в частки):
![]()
![]()
Формула вуглеводню С4Н10
4. Робимо перевірку виведеної формули вуглеводню за молярною масою:
М(С4Н10)=58 г/моль
Відповідь: формула вуглеводню С4Н10 -бутан
ІІІ. Виведення молекулярної формули за відомими масою, об’ємами або кількістю речовини продуктів згорання
Приклад
Внаслідок спалювання вуглеводню масою 1,5 г утворилися оксид карбону (ІV) об’єму 2,24 л (н.у.) та вода масою 2,7 г. Виведіть формулу вуглеводню, якщо відносна густина його за повітрям становить 1,0345.
![]() Дано:
Дано:
m(CxHy)=1,5г 1. Обчислимо молярну масу вуглеводню:
V(C xHy)=2,24 л ![]()
![]() m(H2O)=2,7г
m(H2O)=2,7г ![]()
![]() D(CxHy)пов=1,0345 2. Обчислимо кількість речовини вуглеводню масою 1,5 г
D(CxHy)пов=1,0345 2. Обчислимо кількість речовини вуглеводню масою 1,5 г
CxHy - ?
Mпов = 29 г/моль 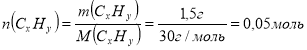
3. Обчислимо кількість речовини оксиду карбону (ІV) об’ємом 2,24 л:
![]()
4. Обчислимо кількість речовини води масою 2,7 г:
![]()
5. Обчислимо співвідношення кількостей речовин вуглеводню, оксиду карбону (ІV) та води:
СхНу + О2 → СО2 + Н2О
υ (CxHy) : υ (СО2) : υ (Н2О)
![]()
![]()
![]() 0,05 : 0,1 : 0,15
0,05 : 0,1 : 0,15
0,05 0,05 0,05
![]()
![]() 1 : 2 : 3
1 : 2 : 3
![]()
СхНу + О2 → 2 СО2 + 3Н2О
6. Обчислимо число атомів Карбону і Гідрогену у вуглеводні:
х=2; у=6; С2Н6; М(С2Н6) = 30 г/моль
Відповідь: Формула вуглеводню С2Н6 (етан)
IV. Виведення молекулярної формули за об’ємом кисню, необхідного для спалювання органічної речовини
Приклад
На спалення 0,5 моль етиленового вуглеводню витрачається 33,6 л кисню (н.у.). Встановити формулу сполуки.
![]() Дано:
Дано:
n(СnH2n) = 0,5 моль 1. Знаходимо кількість речовини кисню за умовою:
![]() V(O2) = 33,6 л
V(O2) = 33,6 л ![]()
СnH2n - ? 2. Складаємо рівняння реакції горіння етиленового вуглеводню у загальному вигляді і розставляємо коефіцієнти:
СnH2n + хO2 → nСО2 + nН2О
2x = 2n + n
2x=3n
![]()
3.Складаємо пропорцію:
На 1 моль СnH2n йде 1,5(n) моль O2
На 0,5 моль СnH2n йде 1,5 моль О2 (за умовою)
![]()
Отже, у молекулі етиленового вуглеводню два атоми Карбону. А на два атоми Карбону припадає
чотири атоми Гідрогену. Формула вуглеводню С2Н4, це етилен.
Відповідь: формула вуглеводню С2Н4 (етилен)
V. Виведення молекулярної формули за об’ємними відношеннями газів
Приклад
При дегідратації первинного насиченого спирту утворився газоподібний алкен, об’єм якого виявився в 4 рази меншим, ніж об’єм карбон(VI)оксиду, що утворився при спалювані такої ж кількості спирту. Одержаний алкен може повністю знебарвити розчин бромної води, де міститься 16г брому. Який спирт піддали дегідратації?
Дано:
![]() Складаємо рівняння відповідних реакцій:
Складаємо рівняння відповідних реакцій:
![]() m(Br2) = 16г 1) Дегідратація первинного насиченого спирту:
m(Br2) = 16г 1) Дегідратація первинного насиченого спирту:
![]()
![]() СnH2n+1OH - ? СnH2n+1OH СnH2n + H2O
СnH2n+1OH - ? СnH2n+1OH СnH2n + H2O
2) Горіння первинного насиченого спирту:
![]() СnH2n+1OH + О2 СО2 + Н2О
СnH2n+1OH + О2 СО2 + Н2О
3) Приєднання брому алкеном:
![]() СnH2n + Br2 СnH2n Br2
СnH2n + Br2 СnH2n Br2
Складаємо співвідношення реагуючих речовин та продуктів реакції:
V(СnH2n) : V (CO2) = 1:4
4) Знаходимо кількість речовини Брому:
![]() , за рівнянням n(СnH2n) = 0,1 моль
, за рівнянням n(СnH2n) = 0,1 моль
5) За умовою задачі:
![]() 1V СnH2n 4V CO2
1V СnH2n 4V CO2
n(СnH2n) = 0,1 моль
n(CO2) = 0,4 моль
n(СnH2n): n(CO2) = 0,1 : 0,4 = 1:4
6) Формула алкену містить 4 атоми Карбону:
С4Н8
При гідратації алкену добудемо одноатомний насичений спирт С4Н9ОН
Відповідь: С4Н9ОН – бутанол
VІ. Виведення молекулярної формули за рівнянням стану ідеальних газів
Приклад
![]() У сталеву посудину, місткість якої 2,75л, помістили 1,32г насиченого одноатомного спирту. Потім туди ввели 3,36л кисню (н. у.). Після підпалювання спирт повністю згорів, при цьому тиск у посудині за температурою 227ºС становив 306 кПа. Визначте формулу спирту.
У сталеву посудину, місткість якої 2,75л, помістили 1,32г насиченого одноатомного спирту. Потім туди ввели 3,36л кисню (н. у.). Після підпалювання спирт повністю згорів, при цьому тиск у посудині за температурою 227ºС становив 306 кПа. Визначте формулу спирту.
Дано:
Vпосуду = 2,75л 1) За рівнянням Менделєєва-Клапейрона:
m(CnH2n+1OH) = 1,32г ![]()
V(O2) = 3,36л Виводимо формулу для визначення кількості речовини суміші продуктів
T = 227ºС згорання:
![]() P =306 кПа
P =306 кПа ![]() , Т = 227 + 273 = 500 К;
, Т = 227 + 273 = 500 К;
CnH2n+1OH - ? R = 8,314 ![]()
![]()
2) За законом збереження маси речовини, знаходимо масу кисню витраченого для спалювання насиченого одноатомного спирту:
![]() моль
моль
![]()
3) Маса вихідних речовин:
![]()
Маса продуктів реакції:
![]()
![]()
Приймаємо n(СО2) = х,
n(Н2О) = 0,2025-х
Складаємо математичне рівняння за законом збереження мас речовин:
6,12 = 44х + (0,2025-х)18
6,12 = 44х + 3,645 – 18х
2,475 = 26х
х = 0,095
Отже, υ(СО2) =0,095 моль, υ(Н2О) = 0,1075 моль
4) Складаємо рівняння реакції горіння насиченого одноатомного спирту:
![]() CnH2n+1OH + О2 5СО2 + 6Н2О
CnH2n+1OH + О2 5СО2 + 6Н2О
За співвідношенням υ(СО2) : υ(Н2О) = 0,095:0,1075 = 5:6
В сполуці спирту 5 атомів Карбону і 12 атомів Гідрогену.
Отже формула насиченого одноатомного спирту С5Н11ОН
Відповідь: С5Н11ОН – пентанол (аміловий спирт)
VІІ. Виведення молекулярної формули за хімічними властивостями речовин
Приклад №1
Етиленовий вуглеводень, що утворився із 24 г одноатомного насиченого спирту при нагріванні з концентрованою сульфатною кислотою, приєднує 15,3 мл брому (ρ = 3,14 г/см3). Який спирт використали для реакції? Врахуйте, що масова частка виходу алкену становить 75% від теоретичного.
![]() Дано:
Дано:
m(СnH2n+1OH) = 24г 1. Визначаємо масу брому, що приєднує алкен:
V(Br2) = 15,3мл m(Br2) = ρ ![]() V = 15,3 мл
V = 15,3 мл ![]() 3,14 г/мл = 48 г
3,14 г/мл = 48 г
ρ = 3,14 г/см3 2. Визначаємо кількість речовини брому:
![]() ωвих. (СnH2n) = 75% n
ωвих. (СnH2n) = 75% n![]()
СnH2n+1OH - ?
3. Складаємо рівняння відповідних реакцій:
СnH2n + Br2 ![]() СnH2nBr2
СnH2nBr2
СnH2n+1OH ![]() СnH2n + H2O
СnH2n + H2O
4. Визначаємо практичну кількість речовини алкену, що приєднує бром:
n(Br2) = nпр.(СnH2n) = 0,3 моль
5. Обчислимо теоретичну кількість виходу алкену:
![]()
6. Обчислимо молярну масу одноатомного насиченого спирту:
![]()
7. Обчислимо число атомів Карбону в сполуці спирту :
12n +2n +1 +17 = 60
14n =42
n=3
8. Виводимо формулу одноатомного насиченого спирту:
С3Н7OH
Відповідь: для реакції використали пропанол (С3Н7OH)
Приклад №2
Для каталітичного гідрування алкіну невідомого складу потрібно використати 1,7 л водню (н.у.). Така ж сама маса вуглеводню під час взаємодії з бромом утворює 15,24 г тетраброміду з розгалуженим карбоновим скелетом. Визначте формулу алкіну.
![]() Дано:
Дано:
V(H2) = 1,7 л 1. Складаємо рівняння відповідних реакцій:
m(СnH2n-2Br4) = 15,24г СnH2n-2 + 2H2 ![]() СnH2n+2
СnH2n+2
![]() СnH2n-2 + 2Br2
СnH2n-2 + 2Br2 ![]() СnH2n-2Br4
СnH2n-2Br4
СnH2n - ? 2. Обчислимо кількість речовини водню
що вступив у реакцію каталітичного
гідрування алкіну :
![]()
3. Обчислимо кількість речовини брому, що вступив у реакцію:
n(Br2)= 0,076 моль
4. Обчислимо масу брому:
m(Br2) = М ![]() n = 160 г/моль
n = 160 г/моль ![]() 0,076 моль = 12,16 г
0,076 моль = 12,16 г
5. Обчислимо масу алкіну:
m(СnH2n-2) = m(СnH2n-2Br4) – m(Br2) = 15,24 – 12,16 = 3,08 г
6. Обчислюємо кількість речовини алкіну за рівнянням реакції приєднання брому:
n(СnH2n-2) = n(Br2)/2 = 0,076/2 = 0,038 моль
7. Обчислюємо молярну масу алкіну:
![]()
8. Обчислюємо число атомів Карбону в алкіні:
12n + 2n – 2 = 82
14n = 84
n=6
9. Виводимо формулу алкіну:
С6H10
Відповідь: формула алкіну С6H10 (гексин)
Приклад №3
Внаслідок нагрівання насиченого одноатомного спирту з концентрованою йодидноюкислотою утворилась сполука, в якій масова частка йоду становить 74,7%. Визначте формулу одноатомного спирту.
![]() Дано:
Дано:
СnH2n+1OH СnH2n+1OH + НI → СnH2n+1I + H2O
![]() ω(I) = 74,7% Mr(СnH2n+1I) = 14n + 128
ω(I) = 74,7% Mr(СnH2n+1I) = 14n + 128
СnH2n+1OH - ? ![]()
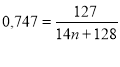
0,747 (14n + 128) = 127
10,458n + 95,616 = 127
10,458n = 31,384
![]() ; С3Н7ОН
; С3Н7ОН
Відповідь: Формула спирту С3Н7ОН (пропанол)
АЛГОРИТМИ РОЗВ’ЯЗУВАННЯ ТИПОВИХ ЗАДАЧ З ОРГАНІЧНОЇ ХІМІЇ
Приклад№1.
Масова частка крохмалю у картоплі становить 20%. Яку масу глюкози можна отримати з картоплі масою 1620 кг, якщо вихід продукту дорівнює 75%?
![]() Дано: Складаємо формулу для знаходження маси глюкози
Дано: Складаємо формулу для знаходження маси глюкози
W((C6H10O5)х)=20% mпр.(глюкози) = mтеор.(глюкози)·η(глюкози)
m(карт)= 1620кг Знаходимо масу крохмалю
![]() Wв =75% m(крохмалю) = ω(крохмалю)· m(картоплі) mпр (C6H12O6 )-? m (крохмалю)=1620кг·0,2=324кг
Wв =75% m(крохмалю) = ω(крохмалю)· m(картоплі) mпр (C6H12O6 )-? m (крохмалю)=1620кг·0,2=324кг
Складаємо рівняння реакції та співвідношення величин
(C6H10O5)х + Н2О→х C6H12O6
![]()
![]()
mпр.(глюкози)=360·103г·0,75=270·103г=270кг
Відповідь: mпр.(глюкози)=270кг
Приклад№2.
Суміш етану та етилену об’ємом 200 мл (нормальні умови) знебарвила бромну воду масою 25г. Розрахуйте об’ємну частку етилену в суміші, якщо масова частка брому в бромній воді становить 3,2 %.
![]() Дано: З бромною водою легко взаємодіє тільки етилен з
Дано: З бромною водою легко взаємодіє тільки етилен з
V(С2Н6+С2Н4)-200мл утворенням 1,2-диброметану:
тр(Вr2) – 25г С2Н4 + Вr2 −> С2Н4Вr2.
![]()
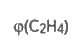 W (Вr2)-3,2% Визначаємо масу і кількість речовини молекулярного брому, який -------------? містився у бромній воді:
W (Вr2)-3,2% Визначаємо масу і кількість речовини молекулярного брому, який -------------? містився у бромній воді:
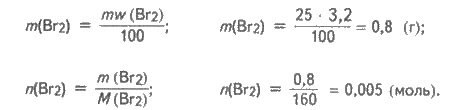
Із рівняння реакції випливає:
n(С2Н4) = n(Вr2); n(С2Н4) = 0,005 (моль).
Обчислюємо об’єм етилену за нормальних умов:
V(С2Н4) = n(С2Н4) Vm; V(С2Н4) = 0,005 • 22,4 = 0,112 (л)= = 112 (мл).
Розраховуємо об’ємну частку етилену у вихідній газовій суміші:
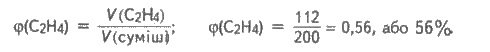
Відповідь: 56%
Приклад№3.
Суміш бензену із циклогексеном масою 5 г знебарвлює бромну воду масою 125 г (масова частка брому 3,2 %). Визначте масу води, що утворюється під час спалювання в кисні такої самої суміші масою 20 г.
|
Дано: т1 (сум) – 5г тр ( (Вr2)-125г W (Вr2) – 3,2% т2(сум)-20г
т (Н2О)-?
|
З бромною водою взаємодіє лише один компонент суміші — циклогексен:
|
Визначаємо масу і кількість речовини брому, що вступив в реакцію:
![]()
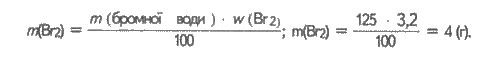
Обчислюємо кількість речовини циклогексена (позначаємо його літерою Ц), що вступив в реакцію з бромом. Із рівняння реакції (а) випливає:
n(Ц) = n(Вr2);n(Ц) = 0,025 (моль).
Розраховуємо масу і масову частку циклогексену в суміші:
m(Ц) = n(Ц) М(Ц);m(Ц) = 0,025 ∙ 82 = 2,05 (г);
Масова частка бензолу (Б) у суміші двох речовин дорівнює:
w(Б) = 1 - w(Ц); wЦ) = 1 - 0,41 = 0,59.
Визначаємо масу і кількість речовини бензолу в зразку суміші масою m' = 20 г:
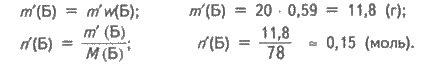
Аналогічно для циклогексену одержуємо m'(Ц) = 8,2 г і n'(Ц) = 0,1 моль.
Складаємо рівняння реакцій горіння бензолу і циклогексену:
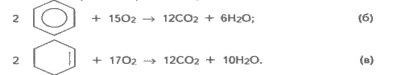
Виходячи з рівняння реакції (б), записуємо:
n6(Н2О) = 3n"(Б);
n6(Н2О) - 3 ∙ 0,15 = 0,45 (моль).
Використовуючи рівняння реакції (в), матимемо:
nа(Н2О) = 5n(Ц);nв(Н2O)= 5-0,1 — 0,5 (моль).
Загальна кількість речовини води, що виділилася під час горіння суміші масою 20 г, становить:
n(Н2О) = nб(Н2О)+nв(Н2O); n(Н2O) = 0,45+0,5= 0,95 (моль).
Обчислюємо масу добутої води:
m(Н2O) = n(Н2О) ∙М(Н2O); m(Н2O) = 0,95 0,18 = 17,1 (г)
Відповідь: 17,1г
Приклад№4.
Етанол об’ємом 30 мл (густина 0,79 г/мл) нагріли з надлишком броміду натрію і сульфатної кислоти. З реакційної суміші виділили брометан масою 42,3 г. Обчисліть масову частку виходу брометану.
|
Дано: V(С2Н5ОН)-30мл p(С2Н5ОН)-0,79г\мл тпр(С2Н5Вr)- 42,3г
ɳ (С2Н5Вr)-?
|
При нагріванні суміші етанолу з бромідом калію та сульфатною кислотою відбуваються реакції: 2KBr + H2SO4 ⇆ 2HBr + K2SO4; (а) С2Н5ОН + НВr ⇆ С2Н5Вr + Н2O. (б)
|
Обчислюємо масу і кількість речовини етанолу, взятого для реакції:
m(С2Н5ОН) = V(С2Н5ОН) ∙ р(С2Н5OН);
m(С2Н5OН) = 30 ∙ 0,79 ≈ 23,7 (г);
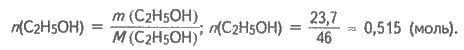
Із рівняння реакції (б) випливає:
n(С2Н5Вr) = n(С2Н5ОН); n(С2Н5Вr) = 0,515 (моль).
Розраховуємо масу брометану, який міг би утворитися при 100 %-му виході:
m(С2Н5Вr) = n(С2Н5Вr) ∙ M(С2Н5Вr);
m(С2Н5Вr) = 0,515 ∙ 109 ≈56,1 (г).
Обчислюємо масову частку виходу брометану:
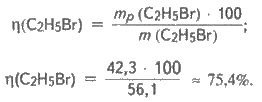
Відповідь: 75,4%
Приклад№5.
Який об’єм 15%-го розчину гідроксиду калію (густина 1,14 г/мл) потрібний для нейтралізації амінооцтової кислоти, добутої з 12,8 г карбіду кальцію.
|
Дано: W(КОН)-15% p(КОН)- 1,14г/мл т(СаС2) – 12.8г
Vр(КОН)-? |
Складаємо рівняння реакцій синтезу амінооцтової кислоти з карбіду кальцію: а) одержання ацетилену з карбіду кальцію: СаС2 + 2Н2O −> Са(ОН2) + С2Н2; б) одержання ацетальдегіду (реакція Кучерова): Нg2+ С2Н2 + Н2O −> СН3СОН; в) окиснення ацетальдегіду будь-яким окисником: СН3СОН + [О] −> СН3СООН; г) хлорування оцтової кислоти: СН3СООН + Сl2 −> СlСН2СООН + НСl; д) взаємодія хлороцтової кислоти з аміаком: СlСН2СООН + 2NH3 −> H2NCH2COOH + NH4Cl. |
Визначаємо кількість речовини СаС2:
![]()
Із рівнянь реакцій а—д випливає, що
n(H2NCH2COOH) = n(СаС2); n(H2NCH2COOH) = 0,2 моль.
З рівняння реакції нейтралізації кислоти:
H2NCH2COOH + КОН -> H2NCH2COOK + Н2О випливає, що
n(КОН) = n(H2NCH2COOH); n(КОН) = 0,2 моль.
Обчислюємо масу потрібного КОН:
m(КОН) = n(КОН) ∙ M (КОН); М(КОН) = 0,2 ∙ 56 = 11,2 (г).
Обчислюємо масу і об’єм розчину гідроксиду калію:
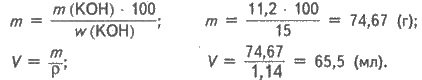
Відповідь: 65,5 мл.
Приклад№6.
Як можна добути анілін, виходячи з метану і не використовуючи інші органічні сполуки? Зазначте умови перебігу реакцій.
Розв’язання. Проводячи піроліз метану, можна добути ацетилен:
t
2СН4 —> С2Н2 + ЗН2.
При наявності вугільного каталізатора з ацетилену можна добути бензол:
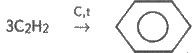
Під дією нітруючої суміші (суміш концентрованих нітратної та сульфатної кислот) на бензол утворюється нітробензол:
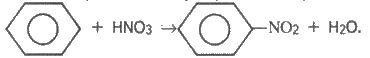
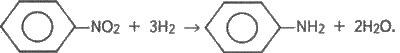
З нітробензолу можна добути анілін за реакцією Зініна, використовуючи як відновник судьфід амонію, залізо у кислому середовищі або водень за наявності каталізаторів, наприклад:
Список використаної літератури
- Березан О.В. Органічна хімія: навч. посіб. – Тернопіль : Підручники і посібники, 2012. – 208 с.
- Кузьменко М.Є., Єрьомін В.В. Хімія. 2400 для школярів та абітурієнтів / Пер. з рос. – Тернопіль: Навчальна книга – Богдан, 2001. – 560 с.
- Попель П. П. Хімія (рівень стандарту) : підруч. для 10 кл. закладів загальної середньої освіти / П. П. Попель, Л. С. Крикля. — Київ : ВЦ «Академія», 2018. — 256 с. : іл.
- Речицький О.Н., Решнова С.Ф. Навчально-методичні рекомендації “Державна атестація студентів з хімії” для студентів IV-V курсів спеціальності Хімія денної, заочної та екстернатної форм навчання Інституту природознавства - Херсон , 2007. – 93с.
- Електронний носій : ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ https://subject.com.ua/chemistry/admission/168.html
1


про публікацію авторської розробки
Додати розробку

-

Мандзюк Лідія
03.11.2023 в 19:37
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Литвинова Олеся Миколаївна
06.09.2023 в 10:22
Дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Гєрман Олександра Олександрівна
24.01.2023 в 14:32
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Присяжна Олена Володимирівна
15.11.2022 в 13:42
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Костіна Неля Миколаївна
26.06.2022 в 16:41
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Бицина Оксана Валеріївна
17.09.2021 в 07:25
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 3 відгука