Навчальний посібник "Система практично зорієнтованих завдань з хімії"
У посібнику представлена система практично зорієнтованих завдань і дослідів з ужиткової хімії з теми "Хімічні явища", яка вивчається в 9 класі. Кожна тема містить опорний конспект з ключових питань теми, завдання для виконання на уроці та вдома, розміщені в порядку зростання їх складності, досліди з ужиткової хімії. Використання практично зорієнтованих завдань є одним із шляхів реалізації компетентнісного підходу в освіті й у той же час забезпечує підвищення ефективності навчального процесу. Посібник може бути використаним у процесі вивчення хімії на уроках і при виконанні домашніх завдань.

система завдань з хімії для 9 класу
З ТЕМИ «ХІМІЧНІ РЕАКЦІЇ»
![]()
![]() ЗМІСТ
ЗМІСТ
Тема 1. Класифікація хімічних реакцій. Реакції сполучення, розкладу, заміщення, обміну………………………………………….3
Тема 2. Окисно-відновні реакції, їхнє значення………………….….
Тема 3. Тепловий ефект реакції. Екзотермічні й ендотермічні реакції…………………………………………………..………….….
Тема 6. Оборотні й необоротні реакції……………………...………
Тема 1. Класифікація хімічних реакцій. Реакції сполучення, розкладу, заміщення, обміну
|
|
|||||
|
За тепловим ефектом |
За кількістю і складом вихідних речовин і продуктів реакції |
За зміною ступеня окиснення елементів |
За ознакою оборотності |
||
|
Типи хімічних реакцій
|
|
||||
|
сполучення розкладу заміщення обміну |
|||||
|
а + в = с с = а + в а + вс = ас + в ав + сд = ад + св |
|||||
|
|
|||||
Реакції сполучення – хімічні реакції, у результаті яких з кількох речовин утворюється одна.
Наприклад:
С + О2 = СО2
СО2 + Н2О = Н2СО3
Реакції розкладу – хімічні реакції, у результаті яких з однієї речовини утворюються дві або більше.
Наприклад:
2Н2О = 2Н2 + О2
2КМnО4 = К2МnО4 + МnО2 + О2↑
Реакції заміщення – хімічні реакції між простою і складною речовиною, у результаті яких утворюється інша проста й інша складна речовина.
Наприклад:
2К + 2Н2О = 2КОН + Н2
Zn + Н2SО4 = ZnSО4 + Н2
Реакції обміну – хімічні реакції між двома складними речовинами, у результаті яких вони обмінюються своїми складовими частинами утворюючи дві інші складні речовини.
Наприклад:
СuО + Н2SО4 = СuSО4 + Н2О
NаСl + АgNО3 = NаNО3 + АgСl↓
Завдання 1.
Дайте відповіді на запитання (усно):
- За якими ознаками можуть класифікувати хімічні реакції?
- За якою ознакою виділяються типи хімічних реакцій сполучення, розкладу, заміщення, обміну?
- З'ясуйте, який тип реакції можуть відображати слідуючі схеми (письмово):
1) А + В = АВ 2) АВ = А + В 3) А + ВС = АС + В 4) АВ + СD = АD + СВ
Завдання 2.
У королівстві хімії зібралися хімічні реакції різних типів. Урівняйте їх, визначте до якого типу вони відносяться.
1) С + О2 = СО2_________________________________________
2) _ К + _ Н2О = _ КОН + Н2 _______________
3) СО2 + Н2О = Н2СО3_____________________________________
4) NаСl + АgNО3 = NаNО3 + АgСl______________
5) Zn + Н2SО4 = ZnSО4 + Н2 __________________
6) _ КМnО4 = К2МnО4 + МnО2 + О2_______________________
7) СuО + Н2SО4 = СuSО4 + Н2О___________________
8) _ Н2О = _ Н2 + О2 ___________________________________________
Завдання 3.
Складіть рівняння реакцій за поданими схемами, вкажіть тип реакцій:
Аl + О2 →__________________________________
Н2О →______________________________________
Zn + Рb(NО3)2 →____________________________
НСl + NаОН →______________________________
Завдання 4*.
Буденне та звичне явище запалювання сірника являє собою сукупність хімічних реакцій. Перш ніж загориться деревина, спалахує головка сірника, до складу якої входить сірка. Горять також частинки червоного фосфору, який міститься в обмазці, нанесеній на бокові частини коробки. Для того, щоб сірка й червоний фосфор загорілися при тій температурі, яка утворюється в результаті тертя, необхідне додаткове надходження кисню. Його забезпечує розкладання бертолетової солі КСlО3, яка також входить до складу сірників.
Напишіть рівняння реакцій, що відбуваються при запалюванні сірника. Визначте тип кожної з цих реакцій.
Завдання 5*.
Коли у ХVІІІ столітті вчені з'ясували, що швидкість зростання населення нашої планети значно перевищує швидкість зростання продуктивності рослин, вони передрікали загибель людства від голоду. Для підвищення продуктивності сільськогосподарських рослин їх необхідно підживлювати, вносячи добрива. Проблема синтезу нітратних добрив виявилася досить складною.
У 1918 році Фріц Габер розробив технологію зв’язування азоту повітря в амоніак NH3. Вважається, що це відкриття мало суттєвий вплив на світову історію, вчений був удостоєний Нобелівської премії. Понад 100 млн. тонн амоніаку на рік виробляє сучасна промисловість. Запишіть рівняння реакції отримання даної речовини з азоту та водню. До якого типу відноситься дана реакція? Яке її значення в житті людини?
Завдання 6*.
Сплавляючи сажу з активними металами, отримують їх карбіди: бінарні сполуки, які складаються з атомів Карбону, сполучених з атомами металів. Карбіди магнію, алюмінію, лужноземельних металів легко розкладаються водою. Наприклад, кальцій карбід СаС2 реагує з водою з утворенням кальцій гідроксиду та ацетилену С2Н2.
Напишіть рівняння реакцій отримання кальцій карбіду з кальцію та сажі, та реакцію отримання ацетилену внаслідок взаємодії кальцій карбіду з водою. Визначте тип кожної з цих реакцій. Що вам відомо про використання ацетилену?
Домашня робота
1. Дайте визначення та наведіть приклади реакцій сполучення, розкладу, заміщення, обміну (усно).
Складіть рівняння реакцій за поданими схемами, вкажіть тип реакцій (письмово):
SO2 + H2O →________________________________
КMnО4 →___________________________________
Н2 + СuО →________________________________
FеСl3 + КОН →_____________________________
2. У своїй діяльності людина використовує тугоплавкі метали. Отримати їх досить складно. На допомогу приходить алюмотермія – відновлення металів з їх оксидів алюмінієм. Алюмотермія дозволяє отримувати такі тугоплавкі метали як хром і марганець. Температура реакції взаємодії суміші алюмінію з ферум(ІІ, ІІІ) оксидом Fе3О4 (ця суміш називається термітом) перевищує 20000С. Терміт застосовують для зварювання залізних та чавунних виробів, наприклад, рейок залізниці.
Напишіть рівняння реакції взаємодії алюмінію з ферум(ІІ, ІІІ) оксидом Fе3О4. До якого типу вона відноситься? Яке практичне значення цієї реакції?
3. Обмін речовин – це тисячі хімічних реакцій, які щохвилини відбуваються в кожній клітині живого організму та забезпечують його життєдіяльність. Основу обміну речовин складають взаємопов’язані процеси катаболізму й анаболізму. Катаболізмом називається розкладання складних органічних речовин на більш прості, наприклад, білки розпадаються до амінокислот. При цьому виділяється енергія, необхідна для підтримання життєдіяльності організму. Анаболізм – синтез складних органічних речовин з більш простих. Цей процес потребує затрат енергії.
Визначте, хімічні реакції якого типу відбуваються при катаболізмі й анаболізмі. Яким чином пов’язані ці два процеси? Чи можуть в організмі відбуватися лише процеси анаболізму або катаболізму, і, відповідно, хімічні реакції лише одного якогось типу? Відповідь поясніть.
4. Оцініть значення хімічних реакцій різних типів у житті та діяльності людини. Чи можна виділити один тип хімічних реакцій, який має найбільше значення в житті людини? Відповідь поясніть
Досліди 1-4. Сплануйте та проведіть досліди, у ході яких відбуваються хімічні реакції різних типів: сполучення, розкладу, заміщення, обміну.
Увага! Досліди можна проводити тільки в присутності дорослих.
1.Окиснення мідної дротинки у полум’ї.
2.Розкладання гідроген пероксиду (перекису водню). Прискорити реакцію можна нагріваючи пробірку в долоні.
3. Реакція між залізним цвяхом та купрум (ІІ) сульфатом (входить до складу бордоської суміші).
4. Взаємодія купрум (ІІ) сульфату з натрій гідрокарбонатом (питною содою). Ця реакція проходить дуже повільно.
Опишіть хід цих дослідів за типовим планом:
- назва досліду;
- вихідні речовини;
- умови реакції;
- ознаки реакції;
- продукти реакції;
- рівняння реакції (по можливості);
- висновок.
Тема 2. Окисно-відновні реакції, їхнє значення
![]() Окисно-відновними називаються хімічні реакції, у ході яких елементи змінюють ступені окиснення
Окисно-відновними називаються хімічні реакції, у ході яких елементи змінюють ступені окиснення
Ступінь окиснення – це умовний заряд, який мали б атоми хімічного елемента, якби валентні електрони повністю перейшли до атома з більшою електронегативність.
Електронегативність – умовна величина, яка характеризує здатність атомів хімічних елементів притягувати до себе валентні електрони.
Електронегативність деяких хімічних елементів
|
К |
Nа |
Са |
Мg |
Аl |
Si |
H |
P |
С |
N |
S |
Сl |
О |
F |
|
0,8 |
0,9 |
1,0 |
1,2 |
1,5 |
1,8 |
2,1 |
2,1 |
2,5 |
3,0 |
2,5 |
3,0 |
3,4 |
4,0 |
Правила визначення ступеня окиснення елемента у сполуці:
1. Ступінь окиснення елементів у простих речовинах дорівнює нулю:
![]()
2. Ступінь окиснення елементів у складних речовинах, як правило, дорівнює їх валентності, перед ступенем окиснення першого елемента ставимо знак «+», другого (останнього) – знак «-»:
![]()
Виключенням є формули тих сполук, у яких першим записується символ елемента з більшою електронегативністю:
![]() .
.
3. Сума ступенів окиснення усіх елементів у сполуці завжди дорівнює нулю. Це правило дозволяє визначити ступінь окиснення елементів зі змінною валентністю і ступінь окиснення елементів у формулах сполук, до складу яких входять атоми більш ніж двох елементів:
![]()
Завдання 1.
Дайте відповідь на запитання:
- Які реакції називаються окисно-відновними?
- Дайте визначення ступеня окиснення.
- Які правила визначення ступеня окиснення?
Завдання 2.
Визначте ступені окиснення елементів у сполуках:
- О2, Н2, S8, P4, N2, Al
- CO2, SO2, SO3, H2O, FeCl2, FeCl3
- HNO3, H2SO4, KMnO4, Al2(SO4)3
Завдання 3.
Визначте ступені окиснення кожного елемента в рівнянні реакції, і визначте, чи є ці реакції окисно-відновними.
1) С + О2 = СО2_________________________________________
2) СО2 + Н2О = Н2СО3_____________________________________
3) NаСl + АgNО3 = NаNО3 + АgСl______________
4) Zn + Н2SО4 = ZnSО4 + Н2 __________________
Завдання 4*.
Реакції горіння відіграють першочергову роль у нашому житті ще з тих часів, коли доісторична людина розвела перше багаття. Ці реакції приносять в дім тепло, рухають автомобілі, допомагають добувати цінні речовини з природної сировини.
Запишіть рівняння реакцій горіння вугілля С, метану СН4, ацетилену С2Н2, визначте ступені окиснення елементів. Чому дані реакції відносяться до окисно-відновних?
Завдання 5*.
У процесі дихання клітини організму поглинають кисень, використовуючи його для окиснення поживних речовин, і виділяють вуглекислий газ.
За схемою, яка відображує процес дихання: О2 → СО2, доведіть, що реакції, які відбуваються в нашому організмі, відносяться до окисно-відновних.
Завдання 6*.
Учені вважають, що біля трьох мільярдів років тому на нашій планеті з'явилися перші фотосинтезуючі організми. З тих пір фотосинтез перетворився на явище планетарного масштабу, який забезпечує існування життя на Землі. Зелені рослини акумулюють енергію Сонця, перетворюючи її на енергію хімічних зв’язків органічних молекул, які утворюються в ході фотосинтезу. У результаті фотосинтезу за рік фіксується 3×1018 кДж енергії, що майже в 10 раз перевищує енергію спожитого людством палива за цей же час. Виходячи з сумарного рівняння фотосинтезу: 6СО2 + 6Н2О ![]() С6Н12О6 + О2, доведіть, що фотосинтез є окисно-відновним процесом.
С6Н12О6 + О2, доведіть, що фотосинтез є окисно-відновним процесом.
Домашня робота
1. Визначте ступені окиснення кожного елемента в рівнянні реакції, і визначте, чи є ці реакції окисно-відновними.
1) S + О2 = SО2_________________________________________
2) SО2 + O2 = SО3_____________________________________
3) Н2 + СuО →
4) FеСl3 + КОН →
2*. Виплавка заліза з руди стала визначною подією в історії людства. І хоч докоряв Пліній виробникам заліза, мовляв, створили матеріал для виготовлення гострої смертоносної зброї, все ж маємо визнати, що знаряддя, виготовлені з заліза, суттєво збільшили продуктивність праці, сприяли прогресу людства.
Для отримання заліза у металургії використовують кокс: Fе2О3 + 3С = 2Fе + 3СО. З'ясуйте, чи відноситься дана реакція до окисно-відновних. Яке значення цієї реакції в житті людини?
3*. При пошкодженні шкіри ранку обов’язково слід обробити дезинфікуючим засобом. Одним з таких засобів, знайомим, певно, кожному з нас, є перекис водню. Його знезаражуюча дія пояснюється високою окисною активністю атомарного кисню в момент виділення. Запишіть рівняння реакції розкладу перекису водню, визначте, чи є вона окисно-відновною. Який елемент змінює ступінь окиснення в цій реакції? Яке значення реакції розкладу гідроген пероксиду в житті людини?
4**. Конструктори запропонували оригінальний спосіб очистити атмосферу космічного корабля від вуглекислого газу, який утворюється під час дихання космонавтів, одночасно збагативши її киснем. Для цього необхідно перетворити вуглекислий газ СО2 на кисень О2. Реакція відбувається за рівнянням: КО2 + СО2 = К2СО3 + О2↑. Визначте ступені окиснення елементів. Зверніть увагу на те, що ступінь окиснення може позначатися і дробовим числом. Що спільного в даній окисно-відновній реакції з реакцією розкладу перекису водню, яка розглядалася в попередньому завданні? Яке практичне значення даної реакції? Які перспективи її використання в майбутньому?
Дослід 1.
Вирощувати кристали мідного купоросу порівняно просто. Складніше виростити кристали міді. Для цього на дно склянки насипте шар мідного купоросу СuSО4·5Н2О, засипте його шаром кухонної солі товщиною в 1 см, зверху покладіть фільтрувальний папір або тканину, на яких розмістіть кілька залізних цвяшків, зачищених попередньо наждачним папером. Залізо буде реагувати з мідним купоросом, витісняючи з нього мідь (запишіть рівняння даної реакції, поясніть, чи є вона окисно-відновною). А кухонна сіль уповільнить цю реакцію, тому мідь осяде на залізі не суцільною плівкою, а красивими кристалами.
Тема 3. Тепловий ефект реакції. Екзотермічні й ендотермічні реакції
![]() Тепловий ефект реакції – це виділення або поглинання енергії в ході хімічного процесу. Тепловий ефект реакції пов'язаний зі зміною внутрішньої енергії речовин.
Тепловий ефект реакції – це виділення або поглинання енергії в ході хімічного процесу. Тепловий ефект реакції пов'язаний зі зміною внутрішньої енергії речовин.
Внутрішня енергія речовини включає в себе енергію руху її структурних частинок (молекул, атомів, йонів) та енергію зв’язків між ними.
Екзотермічні реакції – реакції, які відбуваються з виділенням енергії.
При екзотермічних реакціях внутрішня енергія продуктів реакції менша за внутрішню енергію вихідних речовин:
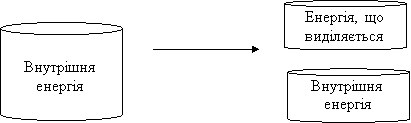
реагенти продукти реакції
Ендотермічні реакції – реакції, які відбуваються з поглинанням енергії.
При ендотермічних реакціях внутрішня енергія продуктів реакції більша за внутрішню енергію вихідних речовин:
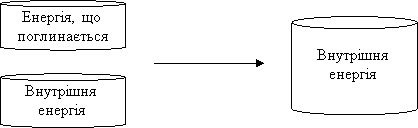
реагенти продукти реакції
Завдання 1.
Що розуміють під тепловим ефектом реакції? Як класифікують реакції за тепловим ефектом?
Завдання 2.
Чим відрізняються екзотермічні та ендотермічні реакції? Як змінюється внутрішня енергія речовин у ході цих реакцій?
Завдання 3.
Термохімічне рівняння 2Мg+О2=2МgО+1203кДж свідчить про те, що
а) при реакції магнію з киснем виділяється 1203 кДж теплоти;
б) при реакції магнію з киснем поглинається 1203 кДж теплоти.
Завдання 4.
До реакцій якого типу: екзо- чи ендотермічних відносяться:
а) спалювання кам’яного вугілля; б) виплавка металів з руд.
З якою метою людина здійснює ці реакції?
Завдання 5.
Серед реакцій, які відбуваються в природі, визначте екзотермічні й ендотермічні:
а) дихання живих організмів;
б) вивітрювання гірських порід;
в) фотосинтез;
г) синтез органічних речовин в організмі (анаболізм);
д) розклад органічних речовин в організмі (катаболізм);
е) розкладання решток рослинних та тваринних організмів.
Завдання 6*.
Під час згорання 1 моль ацетилену С2Н2 виділяється 1255 кДж тепла, а при згоранні 1 моль метану СН4 – 802 кДж тепла. Поясніть, чому для зварювання та різання металів використовується ацетиленово-кисневий пальник, а не метаново-кисневий, хоча метан – дешевший і доступніший за ацетилен?
Домашня робота
1. Наведіть власні приклади екзотермічних та ендотермічних реакцій, які відбуваються в природі та в побуті. Вкажіть на значення цих реакцій.
2. Кожен вид палива має певну питому теплоту згорання, або теплотворну здатність – кількість енергії, яка виділяється при повному згоранні 1 кг палива. В історії людства основними видами палива були: деревина, кам’яне вугілля, нафта та природний газ. Виявіть закономірність у цій зміні, використовуючи дані таблиці:
Питома теплота згорання деяких видів палива, кДж/кг
|
Деревина (суха) |
13 000 |
|
Кам’яне вугілля |
27 000 |
|
Нафта |
44 000 |
|
Природний газ |
44 000 |
|
Водень |
121 000 |
Які ще фактори, крім питомої теплоти згорання, визначають ефективність та доцільність застосування того чи іншого виду палива?
3. Калорійність продукту харчування – це кількість енергії, яка виділяється під час його повного окиснення в організмі. Найважливішими поживними речовинами, які входять до складу продуктів харчування, є білки, жири й вуглеводи. Калорійність жирів становить 3900 кДж на 100 г жиру, білків та вуглеводів – біля 1700 кДж на 100 г речовини. Яку кількість білків, жирів та вуглеводів має спожити людина, якщо її енергетичні потреби становлять 12000 кДж на добу, і задовольняти їх людина буде, споживаючи лише один якийсь вид поживних речовин (наприклад, тільки білки, або тільки вуглеводи)? Чому таке харчування є нераціональним? Яку кількість білків, жирів та вуглеводів має споживати людина, якщо орієнтовне співвідношення поживних речовин білки : жири : вуглеводи = 30% : 20% : 50%.
4*. З позиції хімії поясніть, чому їжу називають паливом для нашого організму.
Дослід 1.
Виділення енергії під час хімічної реакції може відбуватися як у вигляді тепла, так і у вигляді світла. Наприклад, світінням супроводжується кристалізація деяких речовин. Для досліду змішайте 108 г калій сульфату К2SО4 та 100 г натрій сульфату декагідрату (глауберової солі) Nа2SО4·10Н2О. Розчиніть цю суміш у невеликій кількості гарячої дистильованої (у крайньому разі – кип’яченої) води. Розчин залиште в темному місці. При охолодженні розчину, сіль почне кристалізуватися. Щойно з'являться перші кристали – розчин почне іскритися – при 60ºС слабко, а в міру охолодження все сильніше й сильніше. Коли випаде багато кристалів, ви побачите цілий сніп іскор. Світіння й утворення іскор пояснюється тим, що при кристалізації солі подвійної солі К2SО4·Nа2SО4·10Н2О, виділяється багато енергії, яка майже повністю перетворюється на світлову.
Дослід 2.
Ви вже здійснювали розкладання калій перманганату, отримуючи з нього кисень: 2КMnО4 = К2МnО4 + МnО2 + О2.
Якщо у вас вдома є калій перманганат, ми зможемо дослідити властивості іще одного продукту даної реакції – калій манганату. Прожарте невелику кількість калій перманганату. Зверніть увагу, що реакція розкладання цієї речовини – ендотермічна, вона відбувається з поглинанням енергії. Ви знаєте, що водний розчин калій перманганату має рожево-фіолетовий колір. Калій манганат К2МnО4, розчиняючись у воді, забарвлює її в зелений колір. Саме такий колір ви отримаєте, розчинивши продукт реакції розкладу калій перманганату у воді, якщо реакція відбулася до кінця. Через деякий час темно-зелений розчин калій манганату змінює свій колір. Він стає темно-синім, потім – фіолетовим і нарешті – малиновим. Через таку властивість розчин калій манганату називають мінеральним хамелеоном. Зміна кольору пояснюється поступовим окисненням калій манганату киснем повітря і перетворенням його на калій перманганат: 4К2МnО4 + 2Н2О + О2 = 4КMnО4 + 4КОН. Зверніть увагу, якщо перетворення калій перманганату в манганат – реакція ендотермічна, то зворотна реакція перетворення калій манганату в перманганат – екзотермічна.
Тема 4. Швидкість хімічної реакції. залежність швидкості реакції від різних чинників
![]() Швидкість хімічної реакції визначається зміною концентрації реагуючих речовин за одиницю часу.
Швидкість хімічної реакції визначається зміною концентрації реагуючих речовин за одиницю часу.
Чинники, які впливають на швидкість хімічної реакції:
- хімічна природа реагентів, їх хімічна активність;
- температура;
- концентрація реагентів (для реакцій в розчинах або газах);
- ступінь подрібнення та перемішування твердих речовин;
- наявність каталізатора.
Завдання 1.
Наведіть приклади хімічних реакцій, які відбуваються в навколишньому світі, вкажіть, як вони відбуваються: а) дуже швидко; б) швидко, в) повільно, г) дуже повільно.
Завдання 2.
Наведіть приклади однакових хімічних реакцій, які за різних умов відбуваються за більші або менші проміжки часу (наприклад, картопля вариться біля півгодини, а смажиться за 10 хвилин);
Завдання 3.
Які чинники і як впливають на швидкість хімічної реакції?
Завдання 4*.
Як впливає на інтенсивність обміну речовин (сукупність хімічних реакцій, що відбуваються в живих організмах):
а) підвищення або зниження температури навколишнього середовища (для холоднокровних організмів);
б) зниження температура тіла у теплокровних організмів, що знаходяться в стані анабіозу (зимова сплячка тварин);
в) підвищення температури тіла у людини, яка захворіла?
Поясніть, чому лікарі розглядають підвищення температури тіла при хворобі як захисну реакцію організму та не рекомендують приймати жарознижуючі препарати, якщо температура не піднімається вище 38ºС?
Завдання 5*.
Хворі з серцевою недостатністю або з порушенням функції органів дихання при погіршенні самопочуття використовують кисневі подушки. Поясніть, чому дихання чистим киснем є більш ефективним порівняно з диханням повітрям, яке, як відомо, містить лише біля 21% кисню.
Завдання 6*.
Одним з методів підвищення продуктивності тепличних рослин є збагачення повітря в теплиці вуглекислим газом. Збільшення вмісту СО2 у повітрі теплиць дозволяє підвищити врожайність рослин на 50-100%. Поясніть, як зміна концентрації вуглекислого газу впливає на інтенсивність фотосинтезу, сумарне рівняння якого: 6СО2 + 6Н2О → С6Н12О6 + О2↑.
Домашня робота
1. Наведіть приклади випадків з життя, коли бажаним було б прискорити (уповільнити) перебіг хімічних процесів, наприклад, проростання насіння, приготування їжі, псування продуктів харчування, іржавіння заліза тощо, та шляхів, які для цього використовуються.
2*. Не лише домашні господині борються з пилом, але і працівники шахт, цукрових заводів, млинів. Відомо, якщо не вжити застережних заходів, то вугільний і цукровий пил, дрібні частинки борошна в повітрі можуть вибухати. Виходячи з того, що вибух – це хімічна реакція, яка відбувається з дуже великою швидкістю, поясніть, який чинник може викликати вибухи речовин, які за інших умов спокійно горять (вугілля), або навіть не горять взагалі (цукор, мука).
3*.Псування харчових продуктів відбувається внаслідок взаємодії речовин, що містяться в продуктах, між собою та з речовинами довкілля: киснем, водою та ін. Уповільнивши ці реакції, можна збільшити термін зберігання продуктів. Поясніть, чому і як на термін придатності продуктів впливають:
а) зберігання в закритому посуді, загорнутими в папір, алюмінієву фольгу, в герметичних вакуумних упаковках;
б) зберігання в охолодженому або замороженому стані:
в) чому терміни зберігання сухих молочних продуктів у сотні разів більші, ніж свіжого молока;
4*. Для порівняння швидкості взаємодії соляної і оцтової кислот з цинком використовують прилад, зображений на малюнку:
![]()
![]()
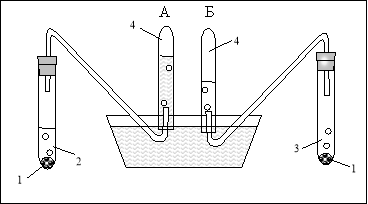
![]()
![]()
Внесіть у малюнок такі доповнення:
а) вкажіть, які речовини позначені цифрами 1-4;
б) як зміниться рівень води у пробірках А і Б через кілька хвилин.
Напишіть відповідні рівняння реакцій.
Дослід 1.
Дослідіть вплив на швидкість розкладання гідроген пероксиду (перекису водню) Н2О2 температури. Для цього невелику склянку з розчином гідроген пероксиду послідовно поміщайте на деякий час у посуд значно більшого об'єму, наповнений водою з певною температурою. Температуру води збільшуйте від 10ºС до 70 ºС з інтервалом в 10 ºС. Швидкість реакції можна визначити за кількістю бульбашок кисню, що виділилися за певний проміжок часу: 1-2 хв.) Складіть графік залежності швидкості реакції від температури.
Дослід 2.
Дослідіть вплив концентрації речовини на швидкість реакції. Для цього приготуйте п’ять порожніх склянок та налийте в них воду так, щоб у кожній наступній склянці води було вдвоє більше, ніж в попередній: у першу склянку – одну столову ложку, у другу – дві, у третю – чотири, у четверту – вісім, у п’яту – шістнадцять. Долийте в кожну склянку по 1 столовій ложці оцту. Послідовно досипайте в кожну склянку по пів чайної ложки питної соди та фіксуйте час, за який відбудеться реакція. Складіть графік залежності швидкості реакції від концентрації речовини.
Дослід 3.
Для досліду, що дозволить виявити вплив ступеня подрібнення твердих речовин на швидкість реакції, вам знадобляться два однакових шматки крейди. Один з них помістіть у склянку цілим, а другий – розтертим в порошок. Долийте в кожну склянку розчин оцтової кислоти (столовий оцет). Що спостерігаєте? У якому випадку швидкість реакції вища?
Тема 5. Поняття про каталіз. Вплив каталізаторів на швидкість хімічних реакцій
![]() Каталіз – явище зміни швидкості реакції в присутності речовини, яка після реакції залишається незмінною.
Каталіз – явище зміни швидкості реакції в присутності речовини, яка після реакції залишається незмінною.
Каталізатор – речовина, яка змінює швидкість хімічної реакції, сама при цьому не витрачається і в кінці реакції залишається незмінною.
Сутність каталізу полягає в утворенні проміжних сполук:
А → В (реакція перетворення речовини А в речовину В, йде без каталізатора);
А + К → АК (проміжна сполука); АК + В → АВ + К (реакція перетворення речовини А в речовину В, яка відбувається з каталізатором К).
Каталізатори, які уповільнюють швидкість реакції, називаються інгібіторами.
Біологічні каталізатори – ферменти – прискорюють біохімічні реакції, які відбуваються в живих організмах.
Завдання 1.
Що таке каталіз? Які речовини називаються каталізаторами?
Завдання 2.
У двох сумішах – порошків питної соди і лимонної кислоти, а також порошкоподібного цинку і йоду – реакція не відбувається. Якщо до кожної з цих сумішей додати трохи води, то в них розпочнуться хімічні перетворення. Чи можна вважати воду каталізатором? Якщо так, то в обох випадках, чи в якомусь одному? Відповідь поясніть.
Завдання 3.
У лабораторії окиснення жирів відбувається при температурі не нижчій за 450ºС, а в організмі людини цей процес здійснюється при температурі її тіла. Як пояснити, що в живих організмах хімічні реакції здійснюються за значно м’якших умов, порівняно з умовами, необхідними для проведення цих же реакцій в лабораторіях та на хімічних виробництвах?
Завдання 4*.
При перегонці нафти (фізичне явище) з неї можна отримати до 5% бензину, октанове число якого становить 60-70 (це – низькоякісний бензин). Здійснюючи хімічну переробку нафти при температурі 550ºС та тискові в 40-50 атмосфер, отримують біля 40% бензину, октанове число якого становить 70-80 (це – бензин середньої якості). Використання каталізаторів дозволяє здійснювати хімічну переробку нафти при температурі в 450ºС й тискові в 20 атмосфер, при цьому з неї отримують біля 40% високоякісного бензину з октановим числом 95 і вище.
Поясніть, яким чином хімічні знання дозволяють підвищити ефективності переробки нафти?
Завдання 5*.
Збільшити октанове число бензину, а отже, підвищити його якість, дозволяє використання антидетонаторів. Найвідомішим і найпоширенішим на сьогодні антидетонатором є плюмбум тетраетил (тетраетилсвинець) Рв(С2Н5)4. Дана речовина є інгібітором, що запобігає занадто швидкому згоранню пального в двигуні автомобіля. У той же час тетраетилсвинець завдає значної шкоди навколишньому середовищу, забруднюючи його.
Оцініть значення використання даного каталізатора. Які можливі шляхи вирішення проблеми забруднення довкілля в цьому випадку?
Завдання 6*.
У сучасному світі більше 500 млн. автомобілів. На їх частку припадає біля 60% усіх викидів у атмосферу. Перш за все це чадний газ СО, оксиди Нітрогену, Сульфуру, сполуки Плюмбуму. Значно зменшити кількість шкідливих речовин у вихлопних газах автомобіля дозволяє використання каталізаторів, які забезпечують доокиснення пального. Завдяки каталізаторам чадний газ, реагуючи з киснем, перетворюється на більш безпечний вуглекислий газ. Обґрунтуйте необхідність використання каталізаторів у транспортних засобах.
Домашня робота
1. Каталітична дія має місце в наступному випадку:
а) зростання швидкості взаємодії водню з бромом при нагріванні;
б) збільшення інтенсивності реакції горіння вугілля після його подрібнення;
в) зростання швидкості реакції горіння фосфору при внесенні його в атмосферу чистого кисню;
г) зростання швидкості реакції розкладу бертолетової солі КСlО3 при додаванні до неї манган (ІV) оксиду.
2. Запишіть рівняння реакцій, описаних у завданні 1. У каталітичній реакції формулу каталізатора записують над знаком «=».
3. Поясніть, чому власники автомобілів виступають проти посипання вулиць сумішшю піску та солі, яка викликає танення льоду навіть в мороз і використовується для боротьби з ожеледицею. Врахуйте, що йони Сl- є каталізаторами корозії заліза та його сплавів.
4. З якою метою до складу харчових продуктів можуть вводиться інгібітори? Чи варто це робити? Що при цьому слід брати до уваги?
Дослід 1.
Каталізатори не просто збільшують швидкість хімічної реакції, часто вони дозволяють проводити ті реакції, які без каталізаторів практично не відбуваються. Для досліду вам знадобиться шматочок цукру-рафінаду та тютюновий попіл. Спробуйте підпалити рафінад. Він плавиться, карамелізується, проте не горить. Посипте цей шматочок дрібкою тютюнового попелу та внесіть його в полум’я. Цукор загорається і горить синюватим полум’ям. Це пояснюється тим, що тютюновий попіл містить сполуки Літію, які прискорюють реакцію горіння цукру.
Дослід 2.
Інгібітори – каталізатори, які сповільнюють швидкість реакції, використовують для сповільнення небажаних хімічних процесів, наприклад, корозії металів. Одним з інгібіторів корозії є уротропін, який використовується в лабораторній практиці як сухе пальне («сухий спирт»). Також уротропін можна придбати в аптеці, де він продається як антисептичний засіб. Дослідіть вплив даної речовини на швидкість корозії заліза. Для цього у дві склянки налийте розчин хлоридної (оцтової) кислоти. В одній з склянок розчиніть трохи уротропіну. Помістіть у ці склянки по залізному цвяху, зачищеному наждачним папером, і порівняйте швидкість корозії заліза в них.
Дослід 3.
Каталізатором розкладу гідроген пероксиду можуть бути не тільки манган (ІV) оксид та ферменти, але й активоване вугілля, залізо, мідь. Дослідіть ці речовини на каталітичну активність. Для цього в чотири невеликі склянки помістіть на дно трішки розтертого в порошок активованого вугілля, залізні та мідні ошурки (або залізний та мідний дріт, попередньо зачищені наждачним папером), подрібнене листя рослини. У кожну склянку налийте по кілька мілілітрів розчину гідроген пероксиду. Оскільки швидкість реакції не залежить від кількості каталізатора, то за швидкістю виділення бульбашок кисню можна зробити висновок про активність різних каталізаторів. Опишіть хід досліду.
Дослід 4.
Створення каталізаторів, активність яких наближається до активності біологічних каталізаторів – ферментів, завдання, над яким працюють сучасні вчені. Деякі результати на цьому шляху вже отримані. Зокрема, виявлено, що високу каталітичну активність виявляють комплексні сполуки металів. Дослідимо каталітичну активність комплексної сполуки Купруму. Для отримання цієї сполуки розчиніть невелику кількість мідного купоросу (входить до складу бордоської суміші) у воді та долийте до цього розчину кілька мілілітрів розчину амоній гідроксиду (нашатирний спирт, продається в аптеці). Поява синьо-фіолетового забарвлення розчину свідчить про утворення комплексної солі Купруму, формула якої Сu[(NН3)4(Н2О)2]SО4. У дві склянки налийте невелику кількість перекису водню. В одну склянку додайте кілька краплин розчину мідного купоросу, а в іншу – розчин комплексної солі. Порівняйте каталітичну активність цих сполук.
Тема 6. Оборотні й необоротні реакції
![]() Оборотною називається хімічна реакція, яка за однакових умов протікає одночасно у двох протилежних напрямках (прямому й зворотному).
Оборотною називається хімічна реакція, яка за однакових умов протікає одночасно у двох протилежних напрямках (прямому й зворотному).
Наприклад: Н2 + І2 ↔ 2НІ, де
Н2 + І2 → 2НІ – пряма реакція; 2НІ → Н2 + І2 – зворотна реакція.
Стан реакційної суміші, коли швидкість прямої реакції дорівнює швидкості зворотної реакції, називається хімічною рівновагою.
Чинники, що впливають на стан хімічної рівноваги:
- зміна концентрації вихідних речовин або продуктів реакції;
- зміна температури;
- зміна тиску (якщо хоча б одна з речовин знаходиться в газоподібному стані, причому в ході реакції об’єм газів змінюється).
Каталізатор дозволяє швидше досягти стану хімічної рівноваги, хоча й не змінює його, оскільки однаково прискорює як пряму, так і зворотну реакцію.
Принцип Ле Шательє:
«Якщо на систему, що перебуває в стані хімічної рівноваги, подіяти ззовні, то положення рівноваги зміститься в ту сторону, що ослаблює зовнішній вплив».
Завдання 1.
Яка найважливіша відмінність оборотних реакцій від необоротних?
Завдання 2.
Нижченаведені реакції охарактеризуйте а) за типом реакції; б) за тепловим ефектом; в) за наявність каталізатора; г) за ознакою оборотності:
SО2 + О2 ![]() SО3 + Q
SО3 + Q
SO2 + H2O ![]() H2SO3 + Q
H2SO3 + Q
SO3 + H2O = H2SO4 + Q
H2SO3![]() SO2 + H2O - Q
SO2 + H2O - Q
Завдання 3.
Озеро Байкал постійно втрачає воду: з нього витікає Ангара, вода озера випаровується, використовується для потреб людини, проте її рівень в цілому не змінюється. Це пояснюється тим, що втрати води компенсуються її надходженням з атмосферних опадів, з підземних джерел, з річок, що впадають в озеро. Таким чином відбувається постійний рух води, хоча рівень її й залишається незмінним.
Наведіть інші приклади динамічної рівноваги природних процесів.
Завдання 4*.
Першим газовану воду отримав Джозеф Прістлі. Саме він виявив, що вода, через яку пропустили вуглекислий газ, стала приємною на смак і краще втамовує спрагу. Кожного разу, відкорковуючи пляшку з газованою водою, ми користуємося результатами цього відкриття.
Напишіть рівняння реакцій, які відбуваються при пропусканні вуглекислого газу крізь воду (при цьому утворюється карбонатна кислота – Н2СО3) та при відкорковуванні пляшки з газованою водою (карбонатна кислота при цьому розкладається на вуглекислий газ і воду).
Запишіть реакцію, що відбувається при пропусканні вуглекислого газу крізь воду як оборотну, зазначте пряму та зворотну реакції. Спрогнозуйте, як на стан хімічної рівноваги вплине: а) збільшення; б) зменшення концентрації вуглекислого газу.
Завдання 5*.
За звичайних умов водень згорає в кисні з утворенням води. При температурі в 3000ºС вода розкладається з утворенням водню та кисню. Існує інтервал температур, коли реакція розкладу води є оборотною. Запишіть рівняння цієї реакції, спрогнозуйте, як на стан хімічної рівноваги вплине: а) підвищення; б) зниження температури.
Завдання 6*.
Озон О3 – алотропна модифікація кисню. У природі озон утворюється при електричних розрядах (наприклад, під час грози), під дією ультрафіолетового випромінювання Сонця. Основна маса озону розміщена в атмосфері на висоті 20-25 км. Озоновий шар захищає живі організми від шкідливого впливу надмірних доз ультрафіолетового випромінювання Сонця. Реакція утворення озону з кисню є оборотною. Запишіть рівняння цієї реакції. З'ясуйте, яким чином на стан хімічної рівноваги впливає зміна температури та тиску.
Домашня робота
- Що таке хімічна рівновага? Які чинники впливають на стан хімічної рівноваги?
- Поясніть наступний дослід. У закриту ємність при температурі 2000ºС і атмосферному тиску поміщена деяка кількість води. Через деякий час в ємності виявлена суміш газів: водяної пари, водню та кисню, склад якої з часом не змінюється.
3. Можна припустити, що принцип Ле Шательє є окремим випадком більш загального закону природи, дія якого поширюється не лише на хімічні, але й на фізичні, біологічні та суспільні процеси. Так маятник, відхилений від положення рівноваги, рухається в протилежну сторону; введення в організм препаратів, що посилюють його активність і працездатність (допінг), приводить до того, що після закінчення їх дії, наступає апатія і спад сил; намагання уряду здійснити соціальні зобов’язання шляхом друкування грошей приводить до підвищення цін, тобто рівновага зміщується таким чином, щоб ослабити задоволення громадян від володіння великою грошовою масою.
Наведіть власні приклади протидії фізичних, біологічних та суспільних процесів впливу ззовні.
4. Більшість реакцій, що відбувається в живих організмах, є оборотними. Їх перебіг забезпечує підтримання сталості внутрішнього складу організму – гомеостазу. Наприклад, оборотною є реакція взаємодії білка крові гемоглобіну Нb з киснем з утворенням оксигемоглобіну: Нb + О2 ↔ НbО. З'ясуйте, як не стан хімічної рівноваги впливає парціальний тиск кисню, виходячи з цього визначте, де в організмі відбувається пряма та зворотна реакції та поясніть, яке це має значення для його життєдіяльності.
Дослід 1.
Вам вже відомо, що реакції обміну відбуваються до кінця, якщо в результаті реакції утворюється осад, газ або малодисоційована речовина, найчастіше, вода. Виходячи з цього правила, деякі учні роблять висновок, якщо в результаті реакції обміну не утворюється осад, газ чи вода, реакція не відбувається взагалі. Спробуємо дослідним шляхом з'ясувати правильність або помилковість даного твердження. Проведемо реакцію між розчинами мідного купоросу СuSО4·5Н2О та кухонної солі NаСl. Для досліду приготуйте насичені розчини цих солей і визначте їх колір. Злийте розчини. Що спостерігаєте? (дослід краще проводити при денному світлі, тоді краще помітна зміна забарвлення). Зміна кольору розчину з насичено-синього на синьо-зелений свідчить про те, що відбулася хімічна взаємодія. Ймовірно, зеленкувате забарвлення може вказувати на утворення СuСl2. Проте концентрований розчин купрум (ІІ) хлориду має смарагдово-зелений колір, а не синьо-зелений колір. Цей колір пояснюється тим, що в розчині знаходяться і сульфат, і хлорид купруму:
СuSО4 + 2NаСl ↔ СuСl2 + Nа2SО4
![]() Отже, якщо в ході реакції обміну не утворюється осад, газ чи вода, не завжди це вказує на відсутність хімічної взаємодії, може відбуватися оборотна реакція.
Отже, якщо в ході реакції обміну не утворюється осад, газ чи вода, не завжди це вказує на відсутність хімічної взаємодії, може відбуватися оборотна реакція.
1


про публікацію авторської розробки
Додати розробку
