Нерозчинні основи, їх властивості
Тема: Нерозчинні основи. Розкладання нерозчинних основ під час нагрівання, взаємодія з кислотами.
Мета:
закріпити знання учнів про хімічні властивості основ; розвивати вміння й навички проведення хімічного експерименту, складання рівнянь хімічних реакцій на прикладі хімічних властивостей лугів і нерозчинних основ; здатність висловлювати свої думки; пізнавальний інтерес учнів до більш глибокого вивчення хімії; через порівняння знаходити подібність та відмінність між розчинними і нерозчинними основами; виховувати особистість, здатну творчо мислити і застосовувати свої знання у нестандартних ситуаціях.
Тип уроку: комбінований.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, роздатковий матеріал, реактиви.
ХІД УРОКУ
I. Організація класу.
Зібратися разом- це початок,
Триматися разом- це прогрес,
Працювати разом- це успіх
Генрі Фрід
II. Актуалізація опорних знань.
«Просто знати – це не все, знання потрібно використовувати»
Гете
- Бесіда:
- Які класи неорганічних сполук ви знаєте? (Оксиди, кислоти, основи, солі)
- Що таке оксиди? Як їх класифікують? (Бінарні сполуки, у яких на другому місці Оксиген. Оксиди: солетворні, несолетворні. Солетворні: кислотні, основні, амфотерні)
- Що таке кислоти? (Сполуки, у яких атоми Гідрогену сполучені з кислотним залишком)
- Що таке солі? (Сполуки, у яких атоми металу сполучені з кислотним залишком)
- Що таке основи? (Сполуки, у яких атоми металу сполучені з гідроксильною групою ОН)
- Як класифікують основи? (Розчинні – луги та нерозчинні)
- Де ми можемо знайти інформацію про розчинність речовини? (У таблиці розчинності кислот, основ, солей)
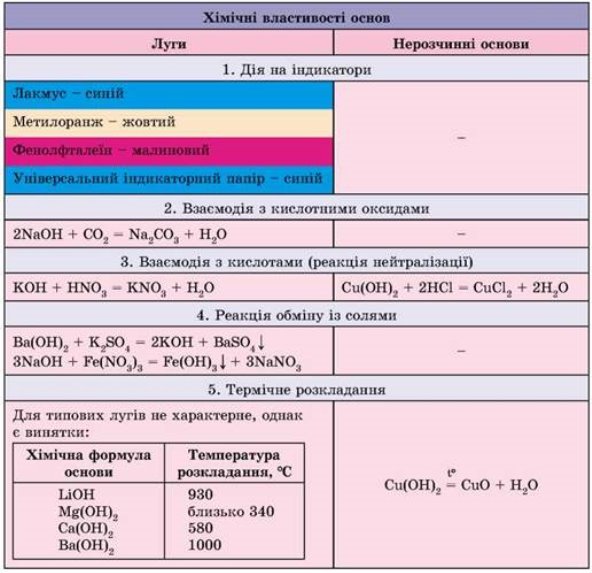
- Які хімічні властивості виявляють розчинні основи? (Взаємодіють з кислотами, кислотними оксидами, солями)
- Яких індикатор краще брати для їх виявлення у розчині? (Фенолфталеїн)
- Виконання вправ:
- Серед запропонованих сполук виберіть лише основи:
|
HCl |
NaOH |
CaSO4 |
Al |
|
SO2 |
Li3PO4 |
KOH |
H2SO4 |
|
H2 |
Fe(OН)2 |
HNO3 |
ZnBr2 |
|
Al(OH)3 |
Ag |
ZnO |
H3PO4 |
|
MgSO3 |
HI |
O3 |
Сu(OH)2 |
- Спробуйте дати назви основам, які ви виписали, класифікуйте їх за розчинністю:
Як правильно давати назву основам? (Якщо елемент з постійною валентністю, то назва цього металу у називному відмінку і слово гідроксид, якщо метал зі змінною валентністю, то в дужках обов’язково зазначається валентність)
NaOH – Натрій гідроксид (Р)
KOH – Калій гідроксид (Р)
Fe(OН)2 – Ферум (ІІ) гідроксид (Н)
Al(OH)3 – Алюміній гідроксид (Н)
Сu(OH)2 – Купрум (ІІ) гідроксид (Н)
Як ми можемо скласти формулу сполуки за її назвою? Давайте пригадаємо алгоритм складання формули гідроксидів за їх назвою.
- Складіть формули гідроксидів за їх назвами:
Літій гідроксид - LiOH
Кальцій гідроксид – Ca(OH)2
Ферум (ІІІ) гідроксид – Fe(OH)3
Плюмбум (ІІ) гідроксид – Pb(OH)2
- З переліку сполук оберіть ті, з якими можуть взаємодіяти розчинні основи і спробуйте дописати рівняння реакцій:
- CaO, CO2, KOH, HCl, CuSO4.
- 2NaOH + CO2 = Na2CO3 + H2O
- NaOH + HCl = NaCl + H2O
- NaOH + CuSO4 = Na2SO4 + Cu(OH)2
З основними оксидами та основами луги не взаємодіють!!!
Пригадаємо загальну схему хімічних властивостей розчинних основ:
Робота з опорною схемою «Хімічні властивості лугів »
+ індикатори Лакмус – синій
![]()
 Фенолфталеїн - малиновий
Фенолфталеїн - малиновий
Метиловий оранжевий - жовтий
![]()
![]() + кислота сіль + Н2O (реакція нейтралізації ) Луги
+ кислота сіль + Н2O (реакція нейтралізації ) Луги
![]()
![]() + кислотний оксид сіль + Н2O (реакція обміну )
+ кислотний оксид сіль + Н2O (реакція обміну )
![]()
![]() + розчинна сіль нерозчинна основа + нова розчинна сіль
+ розчинна сіль нерозчинна основа + нова розчинна сіль
IІІ. Мотивація навчальної діяльності.
Відомий французький письменник Оноре́ де Бальза́к говорив « Ключем до будь - якої науки є знак питання ». Дозвольте поставити вам таке питання: «Чи будуть мати нерозчинні основи тотожні властивості з лугами?»
"Я вважаю, що...."
"Думаю, що … "
Давайте переконаємося у ваших припущеннях.
ІV. Засвоєння нового матеріалу.
- Робота з підручником:
І група «Індикатори» – ст. 172.
ІІ група «Кислоти» - ст. 173-174.
ІІІ «Кислотні оксиди» - ст. 175.
ІV «Солі» - ст. 176.
V «Розкладання» - ст. 176.
Дія на луги
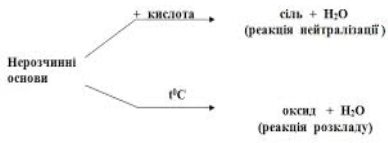
Спробуємо перевірити дію нерозчинних основ на індикатори. Не спостерігаємо зміни кольору, отже, нерозчинні основи не діють на індикатори.
Взаємодія з кислотними оксидами
Нерозчинні основи не вступають у реакції з кислотними оксидами.
Взаємодія з кислотами
Нерозчинні основи взаємодіють з кислотами, утворюючи сіль та воду.
Mn(OH)2 + 2HNO3 = Mn(NO3)2 + 2H2O
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Взаємодія з солями
Серед реагентів усі речовини мають бути розчинними, тому нерозчинні основи не будуть взаємодіяти із солями.
Термічний розклад
Нерозчинні основи на відміну від лугів розкладаються під час нагрівання на основний оксид і воду. 2Fe(OH)3 = Fe2O3 + 3H2O
Cu(OH)2 = CuO + H2O
Fe(OH)2 = FeO + H2O
Експериментальна робота (демонстраційні досліди)
- Повторення правил ТБ.
Для реакцій нам знадобиться Купрум (ІІ) гідроксид, який необхідно одержати. Наприклад, під час взаємодії натрій гідроксиду з купрум сульфатом:
2NaOH + CuSO4 = Cu(OH)2 + Na2SO4
- Взаємодія нерозчинних основ з кислотами.
Завдання . Налийте у дві пробірки свіжодобутий Купрум (ІІ) гідроксид. В одну пробірку долийте по краплинах розбавлену хлоридну кислоту, а в другу - розчину сульфатної кислоти. Запишіть свої спостереження та складіть рівняння реакції.
Сu(ОН)2 + HCl = CuCl2 + H2O
Сu(ОН)2 + H2SO4 = CuSO4 + H2O
Які зміни відбулися з Купрум (ІІ) гідроксидом при взаємодії його з кислотами ? (Купрум (ІІ) гідроксид розчиняється у кислотах з утворенням солі і води)
- Розкладання нерозчинних основ під час нагрівання.
Завдання . Пробірку зі свіжодобутим Купрум (ІІ) гідроксидом нагрівайте у полум’ї спиртівки. Які зміни спостерігаються? Складіть рівняння реакції.
t0C
Сu(ОН)2 = СuО +Н2О – реакція розкладу.
Що ми отримали під час нагрівання купрум (ІІ) гідроксиду?( Купрум (ІІ) гідроксид розкладається з утворенням чорного осаду Купрум (ІІ) оксиду і води )
V. Закріплення вивченого матеріалу.
Завдання І.
Складіть порівняльну таблицю, використовуючи знання про хімічні властивості лугів та нерозчинних основ:
|
Властивості |
Луги |
Нерозчинні основи |
|
Дія на індикатори.
|
|
|
|
|
|
|
|
|
|
|
|
Взаємодія з кислотами. |
|
|
|
|
|
|
|
Взаємодія з кислотними оксидами. |
|
|
|
|
|
|
|
Взаємодія з солями. |
|
|
|
|
|
|
|
Термічний розклад. |
|
|
|
|
|
Зробіть висновок про подібність властивостей та їх відмінність.
Завдання ІІ.
Складіть рівняння термічного розкладу для таких нерозчинних основ:
а) Mg(OH)2 = … + …
б) Au(OH)3 = … + …
в) Cr(OH)3 = … + …
г) Ca(OH)2 = … + …
Завдання ІІІ.
Впишіть пропущені речовини:
а) … + HCl = FeCl3 + …
б) KOH + … = K3PO4 + …
в) … + … = Cu(NO3)2 + H2O
г) NaOH + … = Na2SO4 + …
VІ. Підведення підсумків уроку. Рефлексія.
- Нерозчинні основи взаємодіють з…
- На індикатори нерозчинні основи …
- Із солями, кислотними оксидами нерозчинні основи…
- При нагріванні нерозчинні основи…
- Над чим замислювались протягом уроку?
- Що найбільше сподобалось, запам’яталося?
- Що могло б бути краще?
VІІ. Домашнє завдання.
Опрацювати параграф 33, ст. 173-174, 176, конспект.
Виконати вправу 4, *8 або 9, 12**ст. 180.
*** https://learningapps.org/display?v=peq6fpjt321
Завдання І.
Складіть порівняльну таблицю, використовуючи знання про хімічні властивості лугів та нерозчинних основ:
|
Властивості |
Луги |
Нерозчинні основи |
|
Дія на індикатори.
|
|
|
|
|
|
|
|
Взаємодія з кислотами. |
|
|
|
|
|
|
|
Взаємодія з кислотними оксидами. |
|
|
|
|
|
|
|
Взаємодія з солями. |
|
|
|
|
|
|
|
Термічний розклад. |
|
|
|
|
|
Завдання ІІ.
Складіть рівняння термічного розкладу для таких нерозчинних основ:
а) Mg(OH)2 = … + …
б) Au(OH)3 = … + …
в) Cr(OH)3 = … + …
г) Ca(OH)2 = … + …
Завдання ІІІ.
Впишіть пропущені речовини:
а) … + HCl = FeCl3 + …
б) KOH + … = K3PO4 + …
в) … + … = Cu(NO3)2 + H2O
г) NaOH + … = Na2SO4 + …
Завдання І.
Складіть порівняльну таблицю, використовуючи знання про хімічні властивості лугів та нерозчинних основ:
|
Властивості |
Луги |
Нерозчинні основи |
|
Дія на індикатори.
|
|
|
|
|
|
|
|
Взаємодія з кислотами. |
|
|
|
|
|
|
|
Взаємодія з кислотними оксидами. |
|
|
|
|
|
|
|
Взаємодія з солями. |
|
|
|
|
|
|
|
Термічний розклад. |
|
|
|
|
|
Завдання ІІ.
Складіть рівняння термічного розкладу для таких нерозчинних основ:
а) Mg(OH)2 = … + …
б) Au(OH)3 = … + …
в) Cr(OH)3 = … + …
г) Ca(OH)2 = … + …
Завдання ІІІ.
Впишіть пропущені речовини:
а) … + HCl = FeCl3 + …
б) KOH + … = K3PO4 + …
в) … + … = Cu(NO3)2 + H2O
г) NaOH + … = Na2SO4 + …



про публікацію авторської розробки
Додати розробку
