Основи, їх фізичні властивості властивості, назви
Хімія 8 клас
Тема: «Фізичні властивості основ. Поширеність у природі та використання основ. Вплив на довкілля і здоров’я людини».
Мета уроку: розширити знання про класифікацію неорганічних сполук, сформувати уявлення про основи розчинні і нерозчинні, розглянути склад основ, їх номенклатуру, фізичні властивості, галузі застосування та правила безпеки поводження з ними; розвивати вміння й навички складати формули основ за валентністю металу та визначати валентність металу за формулами основ, давати їм назви, розглянути основні сфери застосування основ і правила безпеки під час роботи з ними, розвивати хімічну мову.
Тип уроку: комбінований.
Хід уроку
І. Організаційний етап.
Правила на уроці.
У – уважні
Р – розумні
О – організовані
К – кмітливі
ІІ. Актуалізація опорних знань.
Бесіда «Мозковий штурм»:
- Розподіліть речовини на 2 групи. Які особливості речовин ви для цього використовували?
Mg, O2, BaO, C, FeSO4, CuO, HCl, S8, Cu(OH)2, H2CO3, NaOH, Al, NaCl, H2, Fe2O3.


- Що таке прості речовини?
- Як класифікують прості речовини?
Розподіліть прості речовини за групами:



- Що таке складні речовини?
- Які класи неорганічних сполук ви знаєте?
Розподіліть складні речовини за класами





- Які сполуки називаються оксидами? (Бінарні сполуки, що містять Оксиген на другомі місті).
- Як класифікують оксиди? (Солетворні: кислотні, основні, амфотерні та несолетворні);
- Яким речовинам відповідають кислотні оксиди? (Кислотам);
- Що таке кислота? (Складна сполука, що містить атоми Гідрогену та кислотний залишок).
- Які речовини відповідають основним оксидам? (Основи)
- Які речовини називають основами? (Сполуки, що містять катіони металу та групи ОН).
IІІ. Мотивація навчальної діяльності.
Вислів давньоримського філософа Сенеки: «Навчаємось не заради школи, а задля життя…»
Кальцій кинули у воду
Оце так наробив погоду!
На воді танок танцює,
Водень догори вирує.
Лакмус колір поміняв,
Чомусь розчин синім став.
У що вода перетворилась,
А може зовсім не змінилась? (Са(ОН)2)
Добавлю луг в зелений розчин,
Спостерігати буду я
Як випадає темний осад,
Зелений осад, мов трава.
Так він в пробірці постояв
І свій колір поміняв.
Був зелений – став цегляний
На великий подив мій!
( утворення гідроксиду феруму (ІІ) і перетворення на гідроксид феруму (ІІІ))
Одні з них надзвичайно небезпечні, інші є життєво необхідними: помічники у господарстві, медицині, будівництві і т.п. Це все сказано про основи. Що це сполуки такі?
ІV. Вивчення нового матеріалу.
План.
1. Загальне поняття про основи.
2. Класифікація основ: луги, нерозчинні основи.
3. Номенклатура основ.
4. Алгоритм складання формул основ за їх назвами.
5. Фізичні властивості основ.
6. Поширення та застосування основ.
7. Заходи безпеки під час роботи з лугами.
Загальне поняття про основи.
Основи (гідроксиди) – це гідрати основних оксидів. Це йонні сполуки, які складаються з іона металічного елемента (Ме) і з одної або декількох гідроксогруп (ОН). Загальна формула основ – Ме(ОН)х.
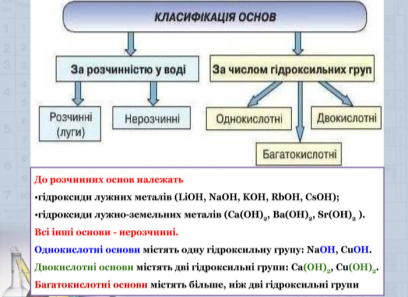
Класифікація основ: луги, нерозчинні основи.
Основи поділяють:
1) за кількістю гідроксогруп -ОН. Кількість гідроксид-іонів, які здатні заміщуватися на кислотні залишки з утворенням солей, визначає кислотність основ:
✵ однокислотні основи: КОН, NaOH, CuOH;
✵ двокислотні основи: Zn(OH)2, Ва(ОН)2, Cu(OH)2, Mg(OH)2;
✵ трикислотні основи: Mn(OH)3, La(OH)3, Ni(OH)3, Ві(ОН)3.
Відома також незначна кількість чотирикислотних основ;
2) за ознакою розчинності у воді:
✵ нерозчинні: Аl(ОН)3, Fe(OH)2, Cu(OH)2;
✵ розчинні: КОН, NaOH, Са(ОН)2, Ва(ОН)2.
Основи, які розчиняються у воді, називають лугами. Розчинність гідроксидів можна визначити за таблицею розчинності. Наприклад, основа NaOH, що складається з катіонів Na+ та аніонів OH-, є розчинною.
Номенклатура основ
Назви основ складають так:
Для елементів зі сталою валентністю:
Назва елемента + слово «гідроксид»
Наприклад: Ca(OH) – кальцій гідроксид, NaOH – натрій гідроксид.
Для елементів зі змінною валентністю:

Наприклад: Fe(OH) – ферум (ІІ) гідроксид, Cu(OH) – купрум (ІІ) гідроксид.
Алгоритм складання формул основ за їх назвами
- Записуємо спочатку хімічний символ металу, а тоді гідроксильну групу ОН.
- Над металічним елементом вказуємо значення його валентності.
- Визначаємо кількість груп ОН за значенням валентності металу, знаючи, що валентність групи І.
- Гідроксильну групу записуємо в дужках і записуємо відповідний індекс.
Наприклад, магній гідроксид.
Валентність Магнію – ІІ, тому гідроксильних груп буде 2.
Отже, формула Mg(OH)2.
Фізичні властивості основ
Луги – це добре розчинні у воді речовини, до складу яких входять лужні метали та гідроксильні групи (ОН). Виняток – Са(ОН)2 – малорозчинний у воді.
NaOH, KOH, LiOH, Ba(OH)2
- Тверді білі речовини, без запаху.
- Милкі на дотик.
- Розчини і розплави лугів проводять електричний струм.
- Під час розчинення у воді виділяється тепло.
Нерозчинні основи – це нерозчинні у воді речовини.
Cu(OH)2, Fe(OH)2, Mg(OH)2
- Тверді.
- Без запаху.
- Не проводять електричний струм.
- Здатні розкладатися на оксид і воду під час нагрівання.
Поширення та застосування основ
У природі луги не трапляються: по-перше, вони розчинні й будуть вимиватися водою, а по-друге, вони дуже активні й легко беруть участь у хімічних реакціях.
Нерозчинні основи можуть входити до складу деяких мінералів у вигляді основних солей. Іржа, яка утворюється на сплавах заліза, теж частково складається з гідроксидів Феруму.
Натрій гідроксид (їдкий натр, або каустична сода) – виготовлення скла, штучних барвників, паперу, синтетичних волокон та очищення нафти. Засіб для очищення каналізаційних труб — це 40 %-й розчин натрій гідроксиду. Натрій та калій гідроксид (їдкий калі) використовують у виробництві твердого й рідкого мила, а також ліків.
Літій гідроксид (LiOH) – наповнення лужних акумуляторів (батарейок), виробництво скла і емалей.
Купрум гідроксид (Cu(OH)2) – надання забарвлення склу й емалям.
Цинк гідроксид (Zn(OH)2) — компонент багатьох фарб і мазей.
Кальцій гідроксид (Cа(OH)2) (гашене вапно) – будівництво, приготування різних будівельних сумішей: штукатурки, шпаклівки тощо, очищення цукру на цукрових заводах. Суспензією кальцій гідроксиду у воді (вапняним молоком) навесні обмазують стовбури дерев для захисту від шкідників.
Магній гідроксид (MgOH)2) – виробництво зубної пасти та ліків.
Заходи безпеки під час роботи з лугами
- Ні в якому разі луги не брати руками!
- Будьте уважні, щоб луг не потрапив на відкриті ділянки шкіри, очі.
- У разі потрапляння лугу на шкіру чи очі повідомте вчителя.
- Ділянку шкіри, на яку потрапив луг, промийте великою кількістю води.
- У разі потрапляння лугу в очі негайно промийте їх спеціальним розчином борної кислоти аптечного виготовлення;
- Розлитий луг нейтралізувати оцтом.
V. Закріплення вивченого матеріалу.
- І. Завдання.
Виберіть серед запропонованих речовин основи:
HCl, Cu(NO3)2, Mg(OH)2, H2SO4, FeO, ZnS, NaOH, AlCl3, H2CO3, K2O, Cr2O3, Co(OH)2.
- ІІ. Завдання.
Скласти формули гідроксидів, зашифровані у піраміді.
OH
Rb Sr K
Li Ba Fe(II) Al Cu(II)
- ІІІ. Завдання.
Вправа «Хрестики-нулики»:
|
NaOH |
HCl |
Al2О3 |
CaSO4 |
CaO |
|
Li3PO4 |
KOH |
SO2 |
К2О |
H2SO4 |
|
H2О |
Fe2O3 |
Cu(OH)2 |
HNO3 |
ZnBr2 |
|
NaCl |
Ag2О |
ZnO |
Al(OH)3 |
H3PO4 |
|
H2CO3 |
MgSO3 |
HI |
Cl2O5 |
Са(OН)2 |
- ІV. Завдання.
Установіть відповідність між назвою та формулою гідроксиду:
|
1 Fe(OH)3 |
а) алюміній гідроксид |
|
|
2 KOH |
б) ферум(ІІ) гідроксид |
|
|
3 Fe(OH)2 |
в) кальцій гідроксид |
|
|
4 Cu(OH)2 |
г) купрум(ІІ) гідроксид |
|
|
5 Al(OH)3 |
д) ферум(ІІІ) гідроксид |
|
|
6 Ca(OH)2 |
е) калій гідроксид |
|
|
7 NaOH |
є) натрій гідроксид |
|
- V. Завдання.
Заповніть картку відповідними основними оксидами та основами.
|
Оксиди |
CaO |
Na2O |
Fe2O3 |
BaO |
|
|
|
|
|
Основи |
|
|
|
|
KOH |
Al(OH)3 |
Sr(OH)2 |
LiOH |
VІ. Підведення підсумків уроку.
- Заповніть пропуски:
- Основи (гідроксиди) – складні речовини, що містять атоми _________ елемента та одну або декілька груп _______.
- Розчинні у воді основи називаються ________ .
- Основи, які у воді не розчиняються називаються ___________.
- В основах існує ___________ зв’язок, бо в їхньому складі містяться метали і неметали.
Ключові слова: луги, ОН, нерозчинні, металічного, йонний.
- Рефлексія
VІІ. Домашнє завдання. 


про публікацію авторської розробки
Додати розробку
