Окисно-відновні реакції, їхнє значення і застосування
Конспект відкритого уроку в 9-ому класі з хімії на тему "Окисно-відновні реакції, їхнє значення і застосування" за підтримкою презентації, флеш-файлів, анімації, гіперпосилань. Мета уроку - за допомогою комп'ютерних та інтерактивних технологій показати учням механізми процесів окиснення та відновлення, визначити їх роль в повсякденному житті, навчити методом електронного балансу розставляти коефіцієнти в окисно-відновних реакціях
Миколаївська загальноосвітня І-ІІІ ст. школа № 40
Миколаївської міської ради
Конспект відкритого уроку
з хімії в 9 класі

Учитель хімії: Біденко Ніна Дмитрівна
Миколаїв-2017
Тема уроку: "Окисно-відновні реакції, їхнє значення і застосування.
Мета уроку: поглибити знання учнів про окисно-відновні реакції, навчивши учнів складати рівняння окисно-відновних реакцій методом електронного балансу, розвивати вміння і навички роботи в команді, вчити самостійно здобувати знання з різних джерел інформації та оформлювати їх у вигляді презентації, формувати вміння виступати перед аудиторією, використовуючи можливості мультимедійної техніки.
Програмне забезпечення: програмно-методичний комплекс «Chemistry8», компілятор уроків «Мальва», Microsoft PowerPoint 2010, Microsoft Word 2010, Paint, Internet Explorer, інтерактивна презентація з елементами анімації «Окисно-відновні реакції. Їх значення і застосування».
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, пам’ятки з алгоритмом складання рівнянь окисно-відновних реакцій методом електронного балансу, правила визначення ступенів окиснення елементів в речовинах, набори хімічного обладнання і реактивів. І. Організаційний момент.
Привітання, перевірка готовності учнів до уроку, налаштування на робочий настрій та побажання успіху в роботі (слайд 1)
II. Актуалізація опорних знань.
1.Повторення основних понять будови атома (слайд 4)
- Який склад атома? ( ядро і електронна оболонка);
- Який заряд несуть елементарні частинки – електрони? (негативний)
- Які електрони ми називаємо валентними, як їх визначити за таблицею Менделєєва? (електрони, що розташовані на зовнішньому електронному рівні);
- Як називають заряджені частинки, що утворюються під час реакцій ( йони)?
- Назвіть позитивні і негативні частинки (катіони і аніони);
- До якої структури намагається атом під час хімічної реакції (завершеної)?
- Яка кількість електронів у завершеної електронної оболонки (вісім)?
- Скільки електронів віддає Натрій і приймає Хлор під час взаємодії (Один)?
Кожна група представляє свою реакцію, класифікує її (міні-проект). Додатково пропонується завдання для обговорення у групі:
Перша група: значення окисно-відновних процесів в природі.
Друга група: значення окисно-відновних реакцій в житті людини.
Третя група: значення окисно-відновних реакцій в техніці, руйнівна роль окисно-відновних реакцій.
III. Мотивація навчальної діяльності.
З процесами окиснення та горіння ми познайомились у 7 –ому класі, коли вивчали тему «Кисень та його властивості» Ще Геракліт помітив, що все в світі складається з протилежностей. Їхня боротьба і визначає сенс будь-якої речі, процесу. Діючи одночасно, ці протилежності утворюють напружений стан, котрим і визначається внутрішня гармонія речей. Сьогодні на уроці ви познайомитеся з окисно-відновними реакціями; їх значенням в житті людини.
Найважливіші процеси на планеті пов'язані із цим типом хімічних реакцій. Окисно-відновні реакції вимагають до себе особливої уваги.
V. Викладення нового матеріалу.
Презентація з обговоренням
«ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЇХ ЗНАЧЕННЯ І ЗАСТОСУВАННЯ» (слайд 5)
Робота за презентацією.
-
Хімічні реакції, які відбуваються зі зміною ступеню окиснення хімічних елементів – окисно-відновні реакції.
(слайд 5) - Що таке ступінь окиснення? (слайд 6)


-
Умовний заряд, який виникає на атомі внаслідок переходу електронів
від одних атомів до інших, або → зміщення спільних електронних пар у та атомів більш електронегативних елементів (слайд 7, 8)

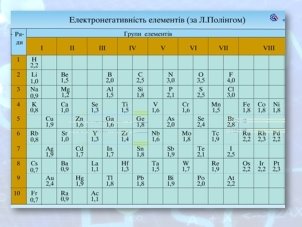
- Демонстрація таблиці електронегативності ( слайд 9)
- Демонстрація зміни ступеню окиснення в атомах під час хімічних реакцій (слайд 10, 11)


- Анімація перебігу електронів в атомах під час хімічної реакції ( слайд 12, 13)
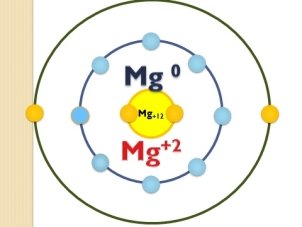
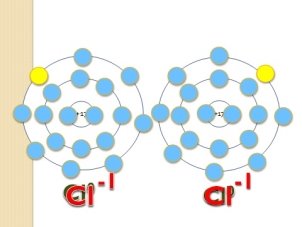
- Ступінь окиснення простих речовин дорівнює нулю (слайд 14)

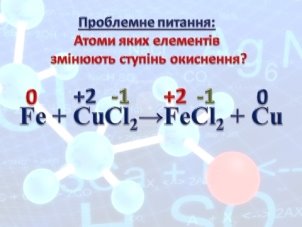
- Проблемне питання за слайдом (15) – атоми яких елементів змінюють ступені окиснення?
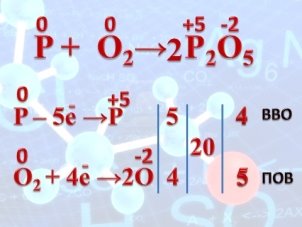
- Демонстрація відео «Горіння фосфору» (слайд 16); запис вчителем етапів окисно-відновної реакції на дошці. Одночасно робота учнів з хімічним словником. Запис понять «окисник», «відновник», «окиснення», «відновлення».
- Демонстрація анімації запису окисно-відновної реакції.(слайд 17, 18)

1) Робота в групах (учні отримують картки з завданням заздалегідь)
Перша група: значення окисно-відновних процесів в житті рослин, тварин, людини.( слайд 19, 20)


Друга група: значення окисно-відновних реакцій в природі.( слайд 21, 22, 23, 24, 25)




Третя група: значення окисно-відновних реакцій в техніці, руйнівна роль ОВР. (слайд, 26, 27, 28, 29, 30, 31)
Заслуховуються повідомлення груп.
Прогнозовані результати:
Перша група. Окисно-відновні реакції найбільш поширені і відіграють значну роль у природі. Вони є основою життєдіяльності, адже з ними пов’язані найважливіші функції живої системи – це дихання, обмін речовин, фотосинтез у рослин. Під час дихання органічні речовини окиснюються до кінцевих продуктів-вуглекислого газу і води, використовуючи для цього кисень. А під час фотосинтезу вуглекислий газ відновлюється до органічних сполук (глюкози), а кисень вивільняється у повітря.
Процеси гниття, бродіння, тління, утворення органічних добрив, та мінеральних солей в ґрунті - це все окисно-відновні реакції. За допомогою цих реакцій постійно відбувається кругообіг всіх хімічних елементів, які входять до складу живих організмів: Оксигену, Карбону, Нітрогену, Гідрогену.
Процес фотосинтезу:
6C+4O2-2+ 6H2+1O-2= C60H12+1O6-2+ 6O20
До складу зеленого пігменту хлорофілу входить Магній, активний метал, горить сліпучим білим полум’ям (слайд 19-А).

фото-слайд 19-А. «Горіння магнію»
Друга група. Окисно-відновні реакції мають велике значення і в житті людини – це отримання тепла в наших домівках при спалюванні вугілля, дров, газу; добування багатьох органічних речовин; виробництво цілого ряду будівельних матеріалів; виробництво лікарських препаратів, харчових та кормових добавок, вітамінів, гормонів, ферментів; виробництво кисломолочних продуктів, сирів, пива, спирту, і багатьох інших продуктів. Природоохоронні заходи, які застосовують для очищення навколишнього середовища, а саме стічних вод і ґрунту від побутового і промислового забруднення ґрунтуються на процесах окиснення та відновлення. Певні види бактерій здатні розкладати, мінералізувати органічні сполуки, які потрапляють у воду та ґрунт.
Окисно-відновна реакція - спалювання сірки: (фото 1)

фото1. «Горіння сірки та утворення сульфітної кислоти»
Третя група. Значення окисно-відновних реакцій в техніці дуже велике. Більшість рідкісних, важливих в техніці металів (нікель, вольфрам, молібден, хром, алюміній та ін.) отримують за допомогою окисно-відновних реакцій. Лужні метали такі як натрій, калій, лужноземельні – кальцій, барій отримують шляхом електролізу із їх солей. В основі електролізу лежать теж окисно-відновні реакції. Виробництво чавуну, сталі, добування деяких неметалів: фосфору, хлору, йоду; добування амоніаку, нітратної та сульфатної кислот ґрунтується також на окисно-відновних процесах.
Дуже негативний процес відбувається в техніці з металами теж на основі окисно-відновних реакцій – це корозія (руйнування) металів, утворення іржі.


Реакція добування алюмінію (глиноземний завод):
2Al2O3 ![]() → 4Al + 3O2
→ 4Al + 3O2

Учні роблять висновки про значення окисно-відновних реакцій.
Проблемне запитання: Яке значення мають окисно-відновні реакції?
VI. Висновки (учні роблять самостійно)
1. Завдяки окисно-відновним процесам на ранніх стадіях існування нашої планети утворились гірські породи і мінерали.
2. Такі процеси, як виверження вулканів, згоряння метеоритних тіл, грозові розряди в атмосфері завжди супроводжуються окисно-відновними процесами.
3. З точки зору хімії, у районах дії вулкану і на дні кратерних озер утворюються поклади самородної сірки. Це відбувається у результаті таких окисно-відновних реакцій:
2H2S + O2 = 2S + 2H2O H2S +2SO2 = H2SO4+ 2S
4. Під час викидів металургійних заводів в повітря потрапляє велика кількість сірчистого газу SO2. Сполучаючись з водою під час дощу, утворюється сірчиста кислота H2SO3 і на землю ллються кислотні дощі. Завдяки цим процесам на потрапляють кислотні дощі, що наносять велику шкоду зеленим рослинам.
S + O2 → SO2 ; SO2 + H2O → H2SO3 (фото 3)

фото 3.Стіннівки про кислотні дощі «Парасолька для Землі»
5. У живій природі окисно-відновні процеси є основою всіх процесів обміну речовин, які є джерелом енергії. Під дією сонячного світла в зелених рослинах відбувається процес фотосинтезу. Він включає десятки хімічних реакцій, однак сумарне рівняння просте:
CO2 + 6 H2O = C6H12O6 +6 O2
У результаті фотосинтезу світлова енергія перетворюється на хімічну енергію зв’язків у молекулах глюкози.
6. Окисно-відновні процеси використовуються в металургії під час виплавки чавуна та сталі, одержання та очищення кольорових, рідкісних металів.
Підсумок: Крок за кроком накопичувався досвід використання окисно-відновних реакцій. Вивчення окисно-відновних процесів продовжується і в наш час. Отже, окисно-відновні процеси відіграють надзвичайно важливу роль у природі, виробництві, техніці та побуті.
VІІ. Підведення підсумків уроку – «Перевір себе».
(Використовую інтерактивний прийом «Незакінчене речення». )
Перевір себе
( під час роботи з інтерактивним завданням, учні дають відповідь на питання, а потім для перевірки відкривають шифровану частину питання)
1.Реакції, які відбуваються із зміною ступенів окиснення атомів, що входять до складу реагуючих речовин називаються … (окисно - відновними).
2.Окисно - відновні реакції це єдність двох процесів … (окиснення і відновлення).
3.Окиснення – це процес … (віддавання електронів атомом елемента).
4.Окисник в окисно - відновних реакціях завжди - … . (відновлюється).
5.Метали, при взаємодії з водою або розчинами кислот, завжди будуть … . (відновниками).
6.Кількість відданих або приєднаних електронів під час окисно – відновної реакції завжди … . (однакова).
7. Оксиген в багатьох окисно – відновних реакціях приєднує електрони, тому його називають … (окисником).
8. Процес окислення завжди супроводжує процес … (відновлення).
9. Коефіцієнти в окисно – відновних реакціях зручно підбирати методом … (електронного балансу).
10. Процес приєднання електронів атомом елемента під час хімічної реакції, це процес… (відновлення).
11. Процес фотосинтезу, виверження вулканів, грозові розряди – це приклади наявності в природі … (окисно – відновних реакцій).
VIII. Домашнє завдання: підручник «Хімія» 9 клас О.В. Григорович
Опрацювати § 15, стор. 88 виконати завдання 178 на стор. 94

1


про публікацію авторської розробки
Додати розробку
