Оксиген. Кисень, склад його молекули, фізичні властивості. Добування кисню в лабораторії. Реакція розкладу. Каталізатор.
Урок з предмету «Хімія» на тему «Оксиген. Кисень, склад його молекули, фізичні властивості. Добування кисню в лабораторії. Реакція розкладу. Каталізатор». Розробка уроку у 7 класі з використанням інтерактивних методів навчання, хімічного експерименту, методу проектів.
|
Тема |
Оксиген. Кисень, склад його молекули, фізичні властивості. Добування кисню в лабораторії. Реакція розкладу. Каталізатор. |
|
Мета уроку: |
навчальна:
розвивальна:
виховна:
|
|
Тип заняття: |
Вивчення нового матеріалу
|
|
Форми роботи: |
Лекція, бесіда, демонстраційний хімічний експеримент, “Мікрофон”, робота з тестами, учнівська презентація
|
|
Обладнання: |
1. Мультимедійна система 2. Лабораторне обладнання: лабораторний штатив, спиртівка, кристалізатор, вата, пробка з газовідвідною трубкою, хімічні стакани, сірники, скіпка 3. Реактиви: калій перманганат, гідроген пероксид, манган(IV) оксид |
|
Основні поняття та терміни |
Хімічний елемент, проста речовина, каталізатор, реакція розкладу, властивості |
|
Міжпредметні зв'язки |
Історія, біологія, математика |
|
Девіз уроку: |
Пізнання починається зі здивування |
Структура уроку
І. Організаційний момент
ІІ. Перевірка домашнього завдання
ІІІ. Актуалізація опорних знань
IV. Мотивація навчальної діяльності
V. Вивчення нового матеріалу
1. Характеристика Оксигену
2. Поширення Оксигену в природі
3. Історія відкриття кисню.
4. Добування кисню у лабораторії.
5. Фізичні властивості кисню
VІ. Узагальнення та систематизація нового матеріалу
VIІ. Домашнє завдання
VІIІ. Підсумок уроку
Хід уроку
І. Організаційний момент
Привітання, перевірка готовності до уроку
ІІ. Перевірка домашнього завдання
1) Індивідуальне опитування - розв’язування задачі
Знайти масову частку Оксигену у Фосфор (V) оксиді.
2) Робота з тестами
1. Укажіть рядок формул, де знаходяться лише прості речовини:
А Fe2O3 , H2, Fe, H2O;
Б Са, О2, СаО, К;
В О2, H2, Fe, Са;
Г Р2О5; NaOH; Na3РО4;Н2О.
2. Укажіть запис, що означає “три атоми Оксигену”:
А 2О3;
Б 3О2;
В О3;
Г 3О.
3. Що означає формула 4О2 ?
А чотири атоми Оксигену;
Б чотири молекули кисню;
В чотири молекули Оксигену;
Г чотири атоми кисню.
4. Укажіть формулу сполуки п'ятивалентного елемента з Оксигеном:
А К2О;
Б СаО;
В Fe2O3 ;
Г Р2О5.
5. Виберіть рядок. У якому перелічені неметалічні елементи:
А Купрум, Аргентум;
Б Силіцій, Ферум;
В Магній, Бор;
Г Оксиген; Гідроген.
ІІІ. Актуалізація опорних знань
Інтерактивна вправа “Мікрофон”
1. Що вивчає хімія?
2. Що таке речовина?
3. Які бувають речовини за складом?
4. Які речовини називаються простими?
5. На які дві групи поділяються прості речовини? За якою ознакою?
6. Що таке властивість?
7. Які бувають властивості?
8. Які ви знаєте фізичні властивості?
ІV. Мотивація навчальної діяльності
Щоб з'ясувати тему уроку я пропоную відгадати загадку:
|
Я живу і не тужу, З ким зустрінуся – дружу, Ми удвох з моїм сусідом Називаємось оксидом. Друзями моїми стали І метали, й неметали. |
Феєрверк влаштую вмить, Бо у мене все горить. Я внизу у тропосфері, Залечу в іоносферу. Мною дихать – всяк мастак Називають мене як? |
Повідомлення теми та завдань уроку
V. Вивчення нового матеріалу
1. Характеристика Оксигену
- Хімічний символ – О
- Порядковий номер - 8
- Період – ІІ
- Номер групи, підгрупа - VІ, головна
- Відносна атомна маса – 16
- Валентність – ІІ
2. Поширення Оксигену в природі
Учні створюють за розповіддю вчителя опорну схему – шпаргалку, за якою будують свою відповідь.
|
Поширення в природі |
|
Як хімічний елемент |
Як проста речовина |
|
- оксиген – найпоширеніший хімічний елемент на Землі, масова частка його у земній корі становить 47%; - хімічний елемент Оксиген міститься у воді, мінералах. Відомо понад 1400 мінералів, наприклад: пісок, глина, крейда; - оксисен – обов’язкова складова частина організмів тварин і рослин, він входить до складу білків, жирів, вуглеводів, з яких складаються живі організми, в організмі людини його 65%. |
- як проста речовина кисень є у повітрі, об'ємна частка становить 21%; - У розчиненому стані в природних водах, забезпечуючи життєдіяльність живих організмів. - Окислюючи органічні речовини він підтримує дихання, а отже, і життя, весь кисень виник на планеті завдяки процесу фотосинтезу. - Але за участю кисню відбуваються й руйнівні процеси: іржавіння металів, горіння, гниття.
|
Первинне закріплення знань
Поясніть вислів: Роль кисню в природі - будівельник і руйнівник.
3. Відкриття кисню – презентація учня
- XVII ст. ____________________
- 1772 р. ____________________
- 1774 р. ____________________
- 1775 р. ____________________
Вперше кисень виділив не хімік, а винахідник підводного човна Дреббель на початку XVII ст. Цей газ він використовував для дихання в човні, при погруженні в воду.
Першим кисень добув шведський хімік К. В. Шєєле в 1772 році.
А через два роки, не знаючи про досліди попередника, - англійський учений Дж. Прістлі.
У 1775 р. французский хімік А. Л. Лавуазьє дізнався про кисень від самого Прістлі. Він протягом двох років займався вивченням процесів горіння.
Лавуазьє помістив у реторту меркурій(ІІ) оксид і запаяв її і нагрів. В результаті чого було отримано ртуть і газ, про який говорив Прістлі. Лавуазьє дослідив кисень і дав йому назву OXYGEN «життєвий газ».
|
№ |
Складові роботи учнів |
Критерії оцінювання проекту |
Можлива кількість балів |
Оцінка вчителя |
|
1. |
Зміст |
Точна інтерпретація інформації. |
20 |
|
|
Наявність малюнків. |
10 |
|
||
|
2. |
Оформлення |
Під час розробки презентації учень дотримувався певної логічної схеми. |
10 |
|
|
Оформлення узгоджується зі змістом. |
10 |
|
||
|
Зображення виконані на високому рівні, стосуються теми проекту і допомагають розкрити його зміст. |
10 |
|
||
|
Текст легко читається. Фон добре пасує кольору тексту. |
10 |
|
||
|
3. |
Грамотність викладу і достовірність інформації |
У роботі немає орфографічних і граматичних помилок. |
10 |
|
|
4. |
Презентація проекту |
Розповідь учня |
20 |
|
|
Разом балів |
100 |
|
||
|
Оцінка |
10 |
|
||
4. Добування кисню, його збирання і виявлення.
Демонстрація 11. Добування кисню з калій перманганату
- Яку речовину використовували для одержання кисню?
- Для чого потрібен жмутик вати?
Демонстрація 12. Добування кисню з гідроген пероксиду.
Демонстрація 13. Збирання кисню витісненням повітря і води.
- Які існують способи збирання?
- На яких властивостях кисню вони базуються?
- Як потрібно розмістити посудину?
- Кисень одержують в результаті реакцій якого типу? Сформулюйте правило.
Демонстрація 14. Виявлення кисню
- Як можна виявити кисень?
І. в промисловості – повітря
ІІ. В лабораторії
А калій перманганат (побутова назва – марганцівка; речовина є
поширеним дезінфікуючим засобом)
2KMnO4 → K2MnO4 + MnO2 + O2↑
Б калій хлорат (тривіальна назва – бертолетова сіль, на честь французького
хіміка К.Л. Бертолле)
2KClO3 → 2KCl + 3O2↑
В калій нітрат
2KNO3 → 2KNO2 +O2↑
Г гідроген пероксид (побутова назва – перекис водню,речовина є
поширеним дезінфікуючим засобом)
2Н2О2 = 2Н2О + О2↑
Д Гідроген оксид (побутова назва – вода)
2Н2О = 2Н2↑+ О2↑
5. Фізкультхвилинка (1 хв.)
Встаньте рівненько, підніміть руки вгору й покажіть, як рухаються молекули у твердих тілах, газах, рідинах.
6. Первинне закріплення знань
Яким зображеним прикладом можно скористатися для збирання кисню в пробірку? Відповідь поясніть.
А 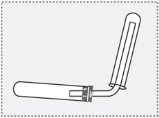
Б 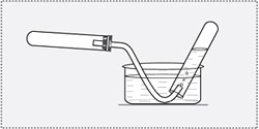
В 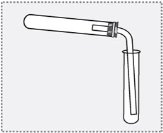
7. Поняття каталізатор
Східна притча
Перед смертю запросив старий араб своїх синів, щоб розділити між ними свій спадок – 17 верблюдів. Першому сину він заповів половину спадку, другому – третину, третьому – дев'яту частину. Довго мудрували сини та нічого не змогли вдіяти. Аж поки не зустріли мудреця, що вів старого верблюда, нав'юченого книгами. Він допоміг братам, додавши свого верблюда до спадку. Розділивши спадок відповідно заповіту старого араба (перший син отримав 9 верблюдів, другий – 6, третій – 2), мудрець забрав свого верблюда і рушив далі. Так і наш чарівний порошок – добути кисень допоміг, а сам не витратився.
Проблема: Поясніть значення слова «каталізатор».
Відповідь: Каталізатор – речовина, яка прискорює хімічну реакцію.
8. Фізичні властивості кисню
- Газ
- Безбарвний
- Без запаху
- Без смаку
- Малорозчинний у воді
- Важчий за повітря
- За температури -1830 С перетворюється на рідину
- За температури -2190 С твердне
VI. Узагальнення і систематизація знань
Робота з тестами
- Де зустрічається кисень у вільному стані?
А у гірських породах;
Б у воді;
В органічних речовинах;
Г у атмосфері.
- В лабораторії кисень добувають реакцією:
А сполучення;
Б розкладу;
В обміну;
Г заміщення.
- Якщо у пробірку із киснем внести тліючу скіпку, то вона:
А погасне;
Б горить менш інтенсивніше;
В горить без змін;
Г спалахує.
4. Кисень можна добути у лабораторії розкладанням:
А пероксиду водню;
Б крейди;
В цукру;
Г з рідкого повітря.
5. Каталізатор – це речовина, що …
А спричиняє зростанню швидкості реакції;
Б спричиняє уповільнення реакції;
В не змінює швидкість реакції;
Г спричиняє виділення теплоти під час реакції.
VIІ. Домашнє завдання
- Опрацювати § 17, 20
- Виконати вправи: 9, 12
- Творче завдання: скласти кроссворд або загадку з теми «Оксиген. Кисень».
VIІІ. Підсумок уроку
Метод «Незакінчене речення»
- Чи цікаво тобі було на уроці…
- Що було найбільш захоплюючим…
- Що тобі далося легше, складніше…


про публікацію авторської розробки
Додати розробку
