Презентація до уроку «Закон збереження маси речовини.Хімічні рівняння»
«Закон збереження маси речовини.Хімічні рівняння»
Мета: ознайомити учнів із законом збереження маси речовин; сформувати уявлення про роботи Р. Бойля, М. В. Ломоносова й А. Л. Лавуазьє пояснити значення закону збереження маси в хімії; розкрити сутність хімічних реакцій; розвиватив учнів пізнавальний інтерес; формувати культуру праці.
Завдання:
Освітні: :
ознайомити учнів із законом збереження маси речовин;
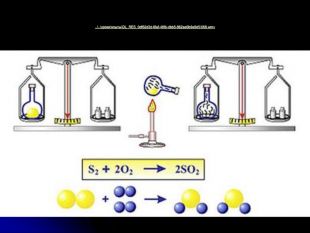
пояснити значення закону збереження маси в хімії;
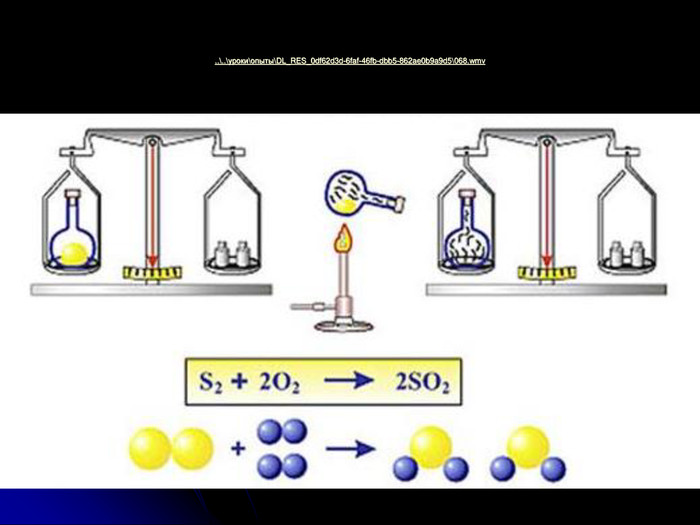
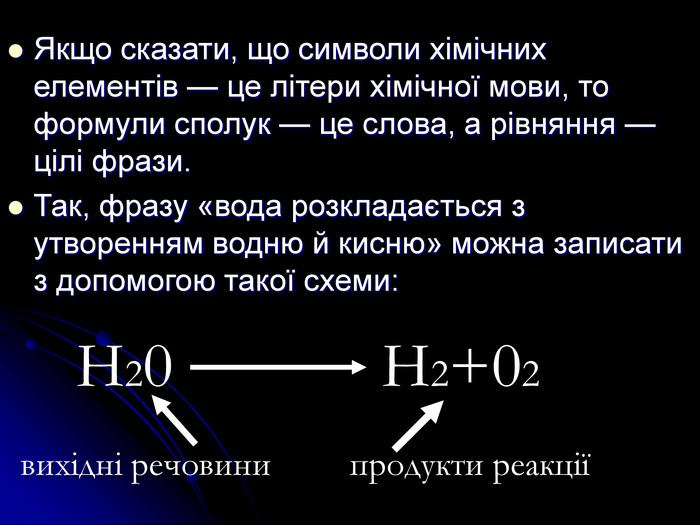
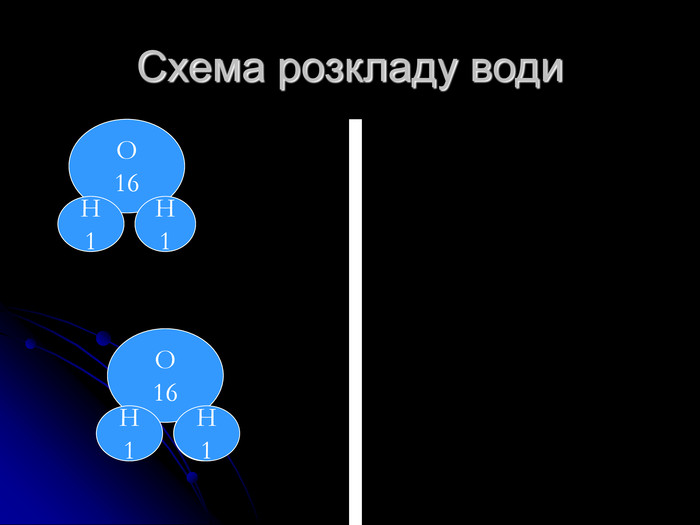
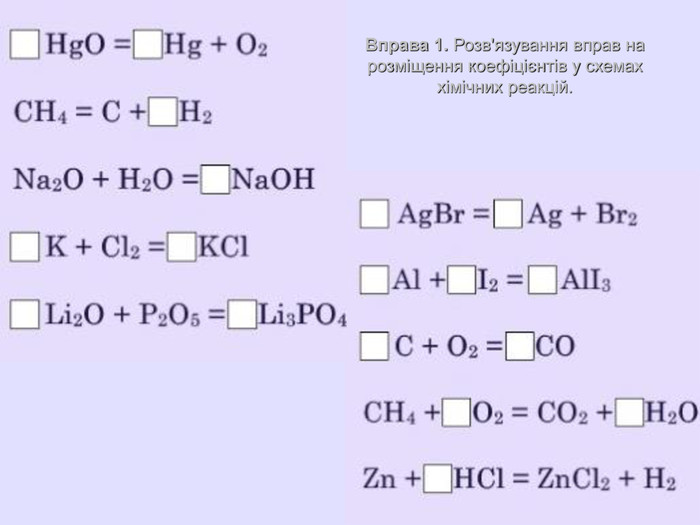
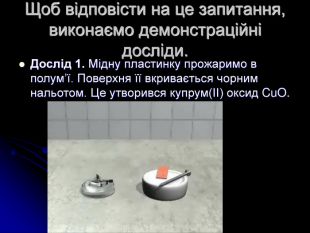
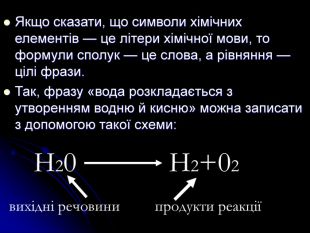
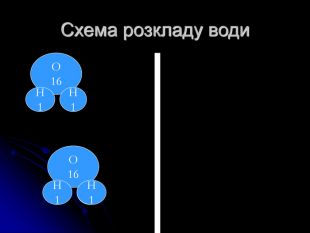
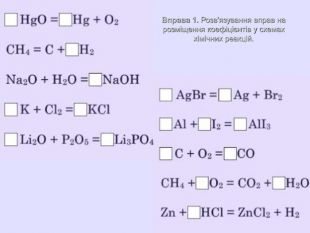
розкрити сутність хімічних реакцій;
Розвиваючі:
розвивати пізнавальний інтерес до досліджуваного предмета;
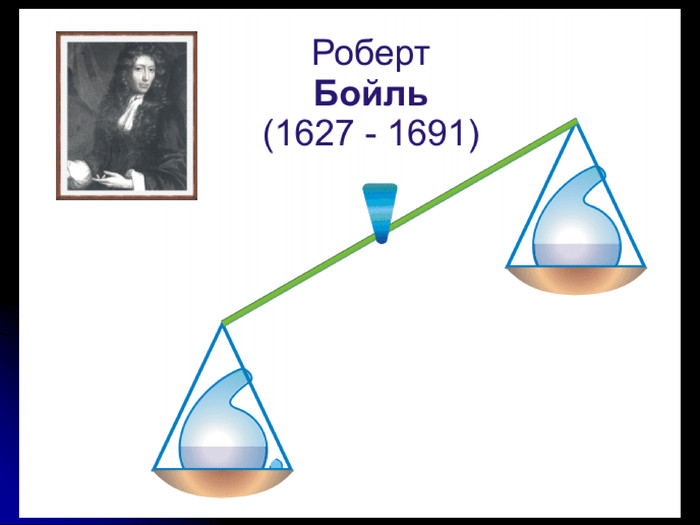
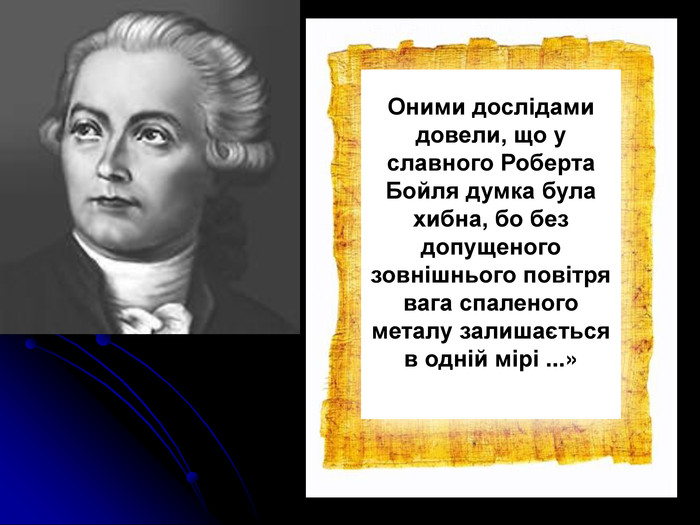
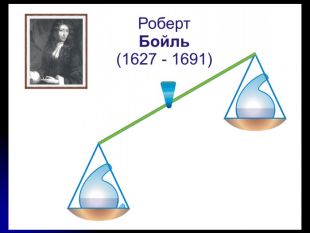
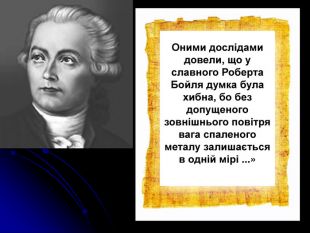
сформувати уявлення про роботи Р.Бойля, М.В.Ломоносова й А.Л.Лавуазьє;
розвивати вміння знаходити помилки в одержуваної інформації;
розвивати практичні вміння і навички учнів;
формувати вміння аналізувати поняття склад і будова речовини;
розвивати вміння логічно викладати свою точку зору, відстоювати її;
розвивати вміння подання отриманої інформації, в тому числі і за допомогою інформаційних технологій;
Виховні:
розвиватив учнів пізнавальний інтерес;
формувати культуру праці.
-
-
-
Чудова робота


про публікацію авторської розробки
Додати розробку