Оксиген. Прості речовини. Явище алотропії. Порівняння фізичних та хімічних властивостей озону та кисню. Їхня біологічна роль.
Тема уроку: Оксиген. Прості речовини. Явище алотропії. Порівняння фізичних та хімічних властивостей озону та кисню. Їхня біологічна роль. .
Навчальна мета: характеризувати та порівнювати алотропні видозміни Оксигену, фізичні та хімічні властивості, способи добування кисню й озону, практичне їх значення; значення озонового шару для життя на Землі.
Розвиваюча мета: розвивати вміння творчо мислити, роботи в групах та виділяти головне.
Виховна мета: виховувати вміння поважати одне одного та бережливого ставлення до навколишнього світу.
Базові поняття і терміни: Оксиген, Прості речовини, Явище алотропії, озон та кисень.
Міжпредметні та внутрішньопредметні зв’язки: екологія, біологія, фізика
Тип уроку: удосконалення знань, умінь та навичок
Методи, форми та прийоми навчання:
Обладнання: підручник, зошит, дошка, мультимедійний проектор.
Структура уроку і час:
- Організаційний етап – 1 хв
- Актуалізація опорних знань – 6хв
- Мотивація навчальної діяльності-6хв
- Вивчення нового матеріалу- 20 хв
- Узагальнення та систематизація- 8 хв
- Підбиття підсумків- 3хв
- Домашнє завдання- 1 хв
Хід уроку
- Організація навчальної діяльності
- Актуалізація опорних знань.
Дайте характеристику Оксигена, як хімічного елемента, та кисню, як простої речовини.
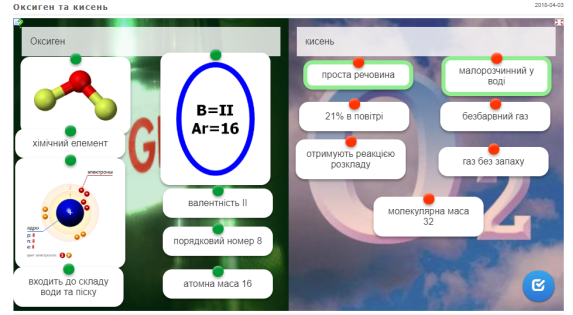
Завдання можна пройти в електронній версії: https://learningapps.org/display?v=ppztnh70k18
3.Мотивація навчальної діяльності
Гра «Слідство ведуть хіміки»
Знайти «загублені» коефіцієнти у наведених рівняннях хімічної реакції та виправіть помилки
Реакції записані на дошці, або на карточках.
2Na + O2 = Na2O3(2)
3Fe + 2O2 = Са(Fe)3O
4P + 5O2 = 2P3(2)O5 S + O2 = SO2
CH4 + 2O2 = CO2 + 2H2O
2Ag + О3 = Ag2O + O2(3)
- Вивчення нового матеріалу
Вчитель:
Алотропія - явище існування хімічного елемента у вигляді двох або кількох простих речовин, різних за властивостями і будовою.
Алотропними видозмінами (форми, модифікації) хімічного елемента – це прості речовини утворені одним і тим самим елементом.
![]()
![]()
![]()

![]()
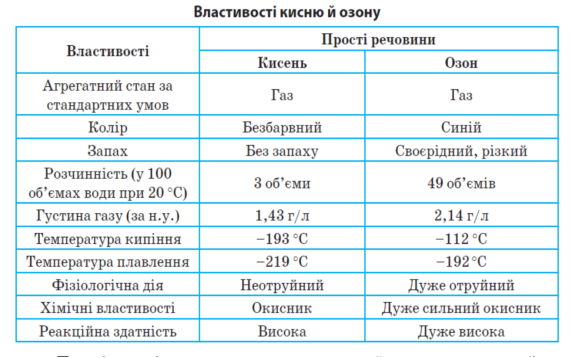
У чому полягає причина різних властивостей алотропних видозмін, а саме кисню й озону? Ви уже знаєте, що властивості речовини зумовлені її складом і будовою.
Кисень й озон мають однаковий якісний склад, але різний кількісний; однакову молекулярну будову, але різну просторову будову молекул: лінійну — в неполярної молекули кисню і кутову — в полярної молекули озону. Отже, крім подібних ці речовини мають різні властивості.
Інтерактивна вправа «Навчаючись вчусь»
Роботу організовують таким чином:
- Учні діляться на 4 групи.
- Кожна група ознайомлюється з інформацією, що міститься на картках.
- Якщо щось не зрозуміло, запитує про це та перевіряє в учителя, чи правильно він зрозумів інформацію.
- Учні готуються до передавання цієї інформації іншим у доступній формі.
- Завдання полягає в тому, щоб поділитися своєю інформацією з іншими учнями й самому дізнатися про щось від них.
- Протягом розповіді кожної групи учні заповнюють таблицю
Картка № 1
Фізичні властивості. Кисень — газ без кольору, смаку і запаху, трохи важчий за повітря. У воді розчиняється мало (в 100 л води при 20 °С розчиняється 3 л кисню). При температурі —183°С і тиску 101,325 кПа кисень переходить у рідкий стан. Рідкий кисень має блакитний колір, втягується в магнітне поле. Озон — газ із характерним запахом, Пари озону світло-синього кольору. Рідкий — синього кольору, а твердий являє собою темно-фіолетові кристали. Температура кипіння -112 °С
Розчинність у воді 49 об’ємів озону в 100 об’ємах води.
Картка № 2
Застосування кисню у промислових масштабах почалося з середини XX ст. — після винаходу пристрою для зрідження та розділення повітря. Як окисник його застосовують у металургії для добування сталі конверторним способом, різання металів, у суміші з іншими багатими на Оксиген сполуками — для окиснення ракетного пального, у газових сумішах для дихання при проведенні підводних робіт, у медицині при порушенні дихання.
Застосування озону зумовлено його дуже високою реакційною здатністю. Він використовується для дезинфекції питної води, очищення димових газів, промислових і побутових стічних вод, вибілювання тканин, а також як окисник ракетного пального.
Картка № 3
Фізіологічна дія. Слід пам’ятати, що надзвичайна окиснювальна здатність озону зумовлює його токсичну дію на людину, тварин і рослини. Навіть малі концентрації озону, що перевищують природні, викликають подразнення дихальних шляхів, кашель, блювоту, запаморочення, стомлюваність. Такі симптоми можна спостерігати у великих містах, де підвищені викиди автомобілів, які містять оксиди Нітрогену, спричиняють перетворення кисню в озон.
Кисень приймає участь в обміні речовин. Окиснюючи поживні речовини, отримані з продуктами харчування, він забезпечує організм енергією. Частина цієї енергії витрачається на підтримання сталої температури тіла, частина – на процеси життєдіяльності.
Згідно з сучасними поглядами в процесі дихання чистим киснем значно прискорюється обмін речовин і організм швидко “згорає”.
Картки №4
Молекула кисню складається з двох атомів O2. Хімічний зв’язок у ній — ковалентний неполярний.
Молекула озону складається з трьох атомів оксигену О3. Вам відомо, що кисень характеризується високою реакційною здатністю. Він реагує з переважною більшістю простих речовин з утворенням оксидів. Майже з усіма металами реакція відбувається вже за кімнатної температури. Більшість металів горить у кисні.З неметалами (крім гелію, неону, аргону, галогенів) кисень зазвичай реагує при нагріванні. Озон значно активніший за кисень. Озон — нестійка сполука, розкладається з утворенням атома Оксигену, що забезпечує підвищену окиснювальну здатність озону.Так, за стандартних умов озон на відміну від кисню реагує зі сріблом і ртуттю.Якісна реакція на озон — взаємодія з калій йодидом із виділенням йоду.
Вчитель:
Отже, давайте з вами переглянемо досліди, які підтвердять розглянуті хімічні властивості.
Демонстрація Взаємодія кисню з неметалами:
1) Із сіркою S + O2 = SO2(сульфур(IV) оксид) Учень на дошці записує рівняння реакцій.
2) З вуглецем C+O2=CO2(карбон(IV) оксид)
Перевіримо наявність карбон(IV) оксиду. Ca(OH)2+CO2=CaCO3+H2O
3) З фосфором. 4P+5O2=2P2O5(фосфор(V)оксид)
Які можна зробити висновки?
Висновок: прості речовини-неметали взаємодіють з киснем. Сполуки, які при цьому утворюються, називають оксидами. Тип реакцій-сполучення.
Взаємодія кисню з металами:
1) Із залізом.'' 3Fe+2O2=Fe3O4
Fe3O4 - подвійний оксид:ферум(II)оксид та ферум(III)оксид.
2) Із магнієм''.2Mg+O2=2MgO(магній оксид)
Взаємодія кисню із складними речовин: CH4+2O2=CO2+2H2O
Рольові вправи «Добування кисню та озону»
1.Учні були обєднані в дві групи та завчасно отримали завдання до цього уроку.
2. Кожен член команди мав свої обов’язки, які вказані у звіті.
3. Кожна група представляє свої результати досліджень, а саме:
- Доповідь з теми
- Відео з підтвердженням інформації
- Запис рівнянь реакції
- Переваги та недоліки
- Звіт де вказується об’єм роботи кожного з групи
Група № 1 «Промисловці»
Тема: добування кисню та озону в промисловості
Група № 2 «Лабораторні працівники»
Тема: добування кисню та озону лабораторії
Інтерактивна вправа «Карусель»
обговорення гострої проблеми з різних позицій.
Тема: «Значення озонового шару для життя організмів на Землі»
5.Узагальнення та систематизація знань.
Створення досьє «Оксиген»
Символ –
Група-
Період-
Алотропні видозміни -
Відносна атомна маса-
Кількість e,p,n -
Кількість е на зовнішньому енергетичному рівні
Валентність-
Підсумки уроку
- Як саме я можу зменшити шкідливий вплив на озоновий шар?
- Д/З
|
Низький рівень |
Середній рівень |
Високий рівень |
|
Опрацювати матеріал за даною темою |
Опрацювати матеріал за даною темою, підготувати повідомлення за матеріалом який не був розглянутий на уроці. |
Опрацювати матеріал. Створити за даною темою Ментальну карту використовуючи сервіс Mindomo.com.ru |
Завдання 3
Технологічна картка уроку
Тип уроку: удосконалення знань, умінь та навичок
Цілі уроку: характеризувати фізичні та хімічні властивості сульфуру, способи добування, практичне значення та застосування. розвивати пізнавальні здібності, логічне мислення, вміння робити висновки, виховувати культуру розумової праці.
Форми організації навчальної діяльності: фронтальна та групова.
Освітня технологія: Інтерактивні вправи
Методи навчання: Бесіда, Розповідь, Гра «Хрестики нолики», Вправа «Асоціації», випереджальне завдання, Інтерактивна вправа «Карусель».
Обладнання: : підручник, зошит, дошка, мультимедійний проектор
Хід уроку
|
Структурні елементи уроку (етапи) |
Діяльність вчителя |
Діяльність учнів |
Прогнозований результат |
|
Актуалізація опорних знань |
Гра «Хрестики нолики» |
Відповіді на запитання |
Відповіді які підтверджують достатній рівень знань для подальшого розгляду теми. |
|
Мотивація навчальної діяльності |
Вправа «Асоціації» |
Учні формулюють тему уроку |
Формулювання теми уроку |
|
Вивчення нового матеріалу |
Розповідь про фізичні та хімічні властивості сульфуру. Доповідь учня Поширення в природі та застосування Демонстрації 2. Зразки сірки та інших природних сполук Сульфуру. Інтерактивна вправа «Карусель» Обговорення теми Фізіологічна дія SO3
|
Конспектують у зошит за вчителем, записують рівняння реакції, розглядають зразки сірки та інших природніх сполук сульфуру. Виражають власну думку з теми Фізіологічна дія SO3 |
Учні характеризують фізичні та хімічні властивості сульфуру, способи добування, практичне значення та застосування |
|
Узагальнення та систематизація
|
Вправа «блок-схема» |
Учні об’єднуються в малі групи та створюють блок схему з теми уроку |
Учні створюють блок схему з теми уроку, яка закріплює знання з даної теми |
|
Підбиття підсумків |
Бесіда: Що з сьогоднішнього уроку я можу використати в повсякденному житті? |
Відповідь на запитання |
Розуміння важливості отриманої інформації на уроці. |
Питання за темою / кількість балів за відповідь
- Сульфур – 16-й елемент періодичної таблиці, який заряд ядра? відносна атомна маса?
- Яка електронна будова атома Сульфуру, а при збудженому стані?
- Які валентності має Сульфур і чому?
- Сульфур часто трапляється у вигляді сполук з іншими елементами. Найважливішими його природними сполуками є сульфіди металів?
- Як застосовується сірка у промисловості й сільському господарстві?
- У воді сірка практично нерозчинна. Де добре розчиняється сірка? Чому?
- Ступінь окиснення сірки може бути? Від чого це залежить?
- Чим пояснюється утворення пластичної сірки ?
- Як випливає з прикладів, у реакціях з металами і деякими неметалами сірка є окисником, а в реакціях з більш активними неметалами?
Всі запитання – 1 бал
Критерії оцінки
|
Рівні навчальних досягнень учнів |
Бали |
Критерії оцінювання навчальних досягнень учнів |
|
I. Початковий |
1 |
Учень (учениця) розпізнає деякі хімічні об'єкти (хімічні символи, формули, явища, посуд тощо) і називає їх (на побутовому рівні); знає правила безпеки під час проведення практичних робіт |
|
2 |
Учень (учениця) описує деякі хімічні об'єкти за певними ознаками; знаєпризначення лабораторного обладнання |
|
|
3 |
Учень (учениця) має фрагментарні уявлення з предмета вивчення і може відтворити окремі його частини; під керівництвом учителя виконує найпростіші хімічні досліди |
|
|
II. Середній |
4 |
Учень (учениця) знає окремі факти, що стосуються хімічних сполук і явищ; складає прості прилади для проведення дослідів і виконує їх під керівництвом учителя; складає з допомогою вчителя скорочену умову задачі |
|
5 |
Учень (учениця) з допомогою вчителя відтворює окремі частини начального матеріалу, дає визначення основних понять; самостійно виконує деякі хімічні досліди, описує хід їх виконання, дотримується порядку на робочому місці; самостійно складає і записує скорочену умову задачі |
|
|
6 |
Учень (учениця) відтворює навчальний матеріал з допомогою вчителя;описує окремі спостереження за перебігом хімічних дослідів; робить обчислення за готовою формулою |
|
|
III. Достатній |
7 |
Учень (учениця) самостійно відтворює значну частину навчального матеріалу, з допомогою вчителя порівнює хімічні об'єкти, описує спостереження за перебігом хімічних дослідів; наводить рівняння реакцій за умовою задачі |
|
8 |
Учень (учениця) самостійно відтворює фактичний і теоретичний навчальний матеріал, порівнює і класифікує хімічні об'єкти; самостійно виконує всі хімічні досліди згідно з інструкцією; робить обчислення за рівнянням реакції |
|
|
9 |
Учень (учениця) виявляє розуміння основоположних хімічних теорій і фактів, наводить приклади на підтвердження цього; робить окремі висновки з хімічних дослідів; з допомогою вчителя розв'язує задачі |
|
|
IV. Високий |
10 |
Учень (учениця) володіє навчальним матеріалом і застосовує знання у стандартних ситуаціях, уміє аналізувати, узагальнювати й систематизувати надану інформацію, робити висновки; робить висновки з практичної роботи; самостійно наводить і використовує необхідні формули для розв'язування задач |
|
11 |
Учень (учениця) володіє засвоєними знаннями і використовує їх у нестандартних ситуаціях, встановлює зв'язки між явищами; самостійно знаходить і використовує інформацію згідно з поставленим завданням; виконує хімічний експеримент, раціонально використовуючи обладнання і реактиви; самостійно розв'язує задачі, формулює відповіді |
|
|
12 |
Учень (учениця) має системні знання з предмета, аргументовано використовує їх, у тому числі у проблемних ситуаціях; аналізує додаткову інформацію; самостійно оцінює явища, пов'язані з речовинами та їх перетвореннями; робить обґрунтовані висновки з хімічного експерименту; розв'язує експериментальні задачі за власним планом; самостійно аналізує та розв'язує задачі раціональним способом |
Контроль за темою
Записати рівняння реакцій, що відповідають таким перетворенням:
а) S → SO2 → SO3 → H2SO4 → H2SO3 → SO2
Домашнє завдання
|
Низький рівень |
Середній рівень |
Високий рівень |
|
Опрацювати матеріал за даною темою |
Опрацювати матеріал за даною темою, підготувати повідомлення цікаві факти про сульфур. |
Опрацювати матеріал. Створити за даною темою інтерактивний плакат використовуючи сервіс Thinglink.com |


про публікацію авторської розробки
Додати розробку
