Олімпіада з хімії 8 клас (запитання та відповіді)
Кожен вчитель-предметник прагне навчити дітей, підготувати до конкурсів, олімпіад...Саме тому у пригоді стануть завдання вже з відповідями для підготовки .
8 клас
У завданнях 1-5 виберіть правильну відповідь
1. (5 балів) Укажіть нуклоне число A нукліда Ванадій-51, його протоне число Z та число нейтронів N.
A Z N
А 51 28 23
Б 23 51 28
В 23 28 51
Г 51 23 28
2. (5 балів) У яких масових співвідношеннях необхідно змішати калій сульфат і воду, щоб отримати
розчин із масовою часткою солі 20 %?
А. 2 : 100; Б. 2 : 10; В. 1 : 4; Г. 20 : 100.
3. (5 балів) Виберіть електронну будову частинки, яка утворюється при приєднанні двох електронів
атомом Сульфуру:
А. 1s 2 2s 2 2p 6 3s 2 3p 4 В. 1s 2 2s 2 2p 6 3s 2 3p 2
Б. 1s 2 2s 2 2p 6 3s 2 3p 6 Г. 1s 2 2s 2 2p 6 3s 0 3p 4
4. (5 балів) Укажіть, як змінюються властивості хімічних елементів у напрямку
Mg → Al → Si → P → S:
А. Радіус атома зростає
Б. Електронегативність зменшується
В. Металічні властивості посилюються
Г. Неметалічні властивості посилюються
Д. Основний характер оксидів послаблюється
Е. Прості речовини, утворені цими елементами, мають ковалентний полярний зв'язок
Є. Число енергетичних рівнів не змінюється
5. (5 балів) Укажіть речовину, яку позначено літерою А в досліді, зображеному на
малюнку.
А. Цинк.
Б. Калій перманганат.
В. Манган(IV) оксид.
Г. Залізо.
До завдань 6-10 наведіть повні розв’язки та пояснення.
6. (15 балів) Хімічні елементи А, Б, В розташовані в одному періоді періодичної системи хімічних
елементів Д.І. Менделєєва. Хімічний елемент А знаходиться в одній групі з радіоактивним елементом Г,
який, як і Полоній, був відкритий М. Склодовською-Кюрі. Для елемента Б відомо, що він посідає друге
місце за поширенням у земній корі і його маса складає приблизно третину маси кори (29,5%), він входить
до складу більшості гірських порід і руд. Елемент В знаходиться в одній групі з елементом Д, що утворює
речовину – продукт фотосинтезу. Проста речовина елементу А може реагувати за підвищеної температури
з простими речовинами елементів Б і В. Масова частка елемента В у сполуці АВ складає 57%.
1) Назвіть елементи А, Б, В, Г, Д.
2) Напишіть формулу речовини АВ.
3) Складіть рівняння зазначених у завданні хімічних реакцій.
Міністерство науки та освіти України
Дніпровська академія неперервної освіти
Дніпровський національний університет імені Олеся Гончара
Олімпіада з хімії 2022-2023
Міський (районний) тур
7. (15 балів) Алхімік зробив велике відкриття, яке зашифрував рівнянням хімічної реакції:
3H 2 O + f 2 g 5 = 2k 3 fg 4 .
1) Що означають символи f, g, k?
2) Розшифруйте та запишіть рівняння хімічної реакції.
3) Опишіть природу та хімічні властивості речовин, зашифрованих алхіміком у рівнянні. Відповідь
підтвердіть написанням характерних хімічних реакцій.
8. (15 балів) Для консервування овочів на зиму бабусі знадобився оцет з масовою часткою оцтової кислоти
9 %. В кухонній шафі стояли дві пляшки: з оцтом (масова частка оцтової кислоти 3 %) та оцтовою есенцією
(масова частка оцтової кислоти 70 %).
1) Допоможіть бабусі розрахувати об’єми розчинів, які знадобляться для приготування оцту
необхідної концентрації об’ємом 0,5 л. Зважте на те, що густина кожного із розчинів дорівнює 1 г/мл.
Обчислення виконайте з точністю до цілих чисел.
2) Обчисліть масу кислоти, яка міститься в 0,5 л її розчину з масовою часткою розчиненої речовини
9%.
3) Іноді для консервування потребують розчин з масовою часткою оцтової кислоти 7%. Як маючи
розчин з масовою часткою кислоти 9% добути 0,5 л розчину з масовою часткою кислоти 7%?
9. (15 балів) Невідома бінарна сполука утворена двома видами хімічних частинок (з однаковою
електронною конфігурацією 1s 2 2s 2 2p 6 3s 2 3p 6 ) у молярному співвідношенні 1:1. Її наважка масою 14,9 г
повністю прореагувала з 20,0 г розчину 98%-ої (за масою) сульфатної кислоти.
1) Установіть природу невідомої речовини та запишіть рівняння відповідної реакції.
2) Визначте масу утвореної солі.
3) Чи реагуватиме водний розчин утвореної солі з металічним магнієм? Якщо так, то запишіть
рівняння відповідної реакції.
10. (15 балів) До складу газової суміші входять: азот − 60%; кисень та карбон(ІV) оксид. Відносна густина
цієї суміші за гелієм 8.
1) Знайдіть об’ємні частки компонентів у суміші.
2) Чи зміниться густина цієї суміші за гелієм, якщо карбон(ІV) оксид замінити на пропан (С 3 Н 8 ) з
такою ж об’ємною часткою?
3) Чи підніметься у повітря кулька, заповнена цією сумішшю газів?
4) Які гази можна використати замість карбон(IV) оксиду такої ж об’ємної частки, щоб зменшити
відносну густину цієї суміші за гелієм.
8 клас
У завданнях 1-5 виберіть правильну відповідь
- (5 балів) Укажіть нуклоне число A нукліда Ванадій-51, його протоне число Z та число нейтронів N.
|
|
A |
Z |
N |
|
А |
51 |
28 |
23 |
|
Б |
23 |
51 |
28 |
|
В |
23 |
28 |
51 |
|
Г |
51 |
23 |
28 |
Відповідь Д
- (5 балів) У яких масових співвідношеннях необхідно змішати калій сульфат і воду, щоб отримати розчин із масовою часткою солі 20 %?
А. Б. 100; : 2 В 10; : 2. 4; : 1 Г. 100. : 20
3. (5 балів) Виберіть електронну будову частинки, яка утворюється при приєднанні двох електронів атомом Сульфуру:
А. 1s22s22p63s23p4 В. 1s22s22p63s23p2
Б. 1s22s22p63s23p6 Г. 1s22s22p63s03p4
4. (5 балів) Укажіть, як змінюються властивості хімічних елементів у напрямку
Mg → Al → Si → P → S:
А. Радіус атома зростає
Б. Електронегативність зменшується
В. Металічні властивості посилюються
Г. Неметалічні властивості посилюються
Д. Основний характер оксидів послаблюється
Е. Прості речовини, утворені цими елементами, мають ковалентний полярний зв'язок
Є. Число енергетичних рівнів не змінюється
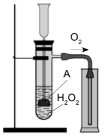
- (5 балів) Укажіть речовину, яку позначено літерою А в досліді, зображеному на малюнку.
А. Цинк.
Б. Калій перманганат.
В. Манган(IV) оксид.
Г. Залізо.
До завдань 6-10 наведіть повні розв’язки та пояснення.
6. (15 балів) Хімічні елементи А, Б, В розташовані в одному періоді періодичної системи хімічних елементів Д.І. Менделєєва. Хімічний елемент А знаходиться в одній групі з радіоактивним елементом Г, який, як і Полоній, був відкритий М. Склодовською-Кюрі. Для елемента Б відомо, що він посідає друге місце за поширенням у земній корі і його маса складає приблизно третину маси кори (29,5%), він входить до складу більшості гірських порід і руд. Елемент В знаходиться в одній групі з елементом Д, що утворює речовину – продукт фотосинтезу. Проста речовина елементу А може реагувати за підвищеної температури з простими речовинами елементів Б і В. Масова частка елемента В у сполуці АВ складає 57%.
- Назвіть елементи А, Б, В, Г, Д.
- Напишіть формулу речовини АВ.
- Складіть рівняння зазначених у завданні хімічних реакцій.
Розв’язування
- Радіоактивний елемент – Радій (елемент Г), знаходиться у ІІ групі, головній підгрупі, отже елемент А – метал. Друге місце в земній корі припадає на Силіцій Si – це елемент Б. Продукт фотосинтезу – кисень, елемент Оксиген (елемент Д) знаходиться в VI групі, отже елемент В – Сульфур S. Таким чином А – Mg, Б-Si, В-S, Г-Ra, Д-O,
- Речовина АВ – MgS, магній сульфід (w( (S)= 57,14%).
- 2Mg + Si = Mg2Si
Mg + S = MgS
- (15 балів) Алхімік зробив велике відкриття, яке зашифрував рівнянням хімічної реакції:
- Що означають символи f, g, k?
- Розшифруйте та запишіть рівняння хімічної реакції.
- Опишіть природу та хімічні властивості речовин, зашифрованих алхіміком у рівнянні. Відповідь підтвердіть написанням характерних хімічних реакцій.
Розв’язування
- f – P (As), g - O, k - H
- 3H2O + P2O5 = 2H3PO4.
- P2O5 – кислотний оксид, взаємодіє з основними оксидами, лугами.
- H3PO4 – кислота, взаємодіє з активними металами, оксидами металів, основами, солями, якщо утворюється осад.
- (15 балів) Для консервування овочів на зиму бабусі знадобився оцет з масовою часткою оцтової кислоти 9 %. В кухонній шафі стояли дві пляшки: з оцтом (масова частка оцтової кислоти 3 %) та оцтовою есенцією (масова частка оцтової кислоти 70 %).
- Допоможіть бабусі розрахувати об’єми розчинів, які знадобляться для приготування оцту необхідної концентрації об’ємом 0,5 л. Зважте на те, що густина кожного із розчинів дорівнює 1 г/мл. Обчислення виконайте з точністю до цілих чисел.
- Обчисліть масу кислоти, яка міститься в 0,5 л її розчину з масовою часткою розчиненої речовини 9%.
- Іноді для консервування потребують розчин з масовою часткою оцтової кислоти 7%. Як маючи розчин з масовою часткою кислоти 9% добути 0,5 л розчину з масовою часткою кислоти 7%?
Розв’язування
- m(р-ну) = 500 г.
m(3% р-ну) = х г, m(70% р-ну) = (500-х) г,
m(реч. у 3% р-ні) = 0,03х г, m(реч. у 70% р-ні) = 0,7(500-х) г, m(реч. у вигот. р-ні) = 500·0,09= 45 г,
Складаємо алгебраїчне рівняння: 0,03х + 0,7(500-х) = 45, звідки х=455.
Отже об’єм розчину з масовою часткою оцтової кислоти 3% складає 455 мл, а оцтової есенції –
500-455=45 мл
- Розчин з масовою часткою кислоти 9% слід розбавити водою, щоб отримати 7%-ний розчин:
Можна застосувати правило хреста:
![]()
![]() m(р-ну) - 9% 7
m(р-ну) - 9% 7
![]()
![]() 7%
7%
m(води) - 0% 2
500 г (мл) розчину складають (7+2=9) частин
Х г (мл) води складають 2 частини
m(води) = (500·2)/9=111 г чи 111 мл води, а кислот из масовою часткою розчиненої речовини треба взати 500-111=389 мл.
- (15 балів) Невідома бінарна сполука утворена двома видами хімічних частинок (з однаковою електронною конфігурацією 1s22s22p63s23p6) у молярному співвідношенні 1:1. Її наважка масою 14,9 г повністю прореагувала з 20,0 г розчину 98%-ої (за масою) сульфатної кислоти.
- Установіть природу невідомої речовини та запишіть рівняння відповідної реакції.
- Визначте масу утвореної солі.
- Чи реагуватиме водний розчин утвореної солі з металічним магнієм? Якщо так, то запишіть рівняння відповідної реакції.
Розв’язування
1. Електронній будові 1s22s22p63s23p6відповідають катіони К+, Са2+, Sc3+, аніони Cl-, S2-, P3-. При поєднанні цих катіонів та аніонів утворюються сполуки KCl, CaS, ScP.
2. Знаходимо масу Н2SО4 у розчині 98%-ої сульфатної кислоти:
![]()
m(H2SO4) = w(H2SO4)∙m(р-ну) = 0,98∙20 г = 19,6 г
3. Знаходимо кількість речовини H2SO4, яка прореагувала з невідомою речовиною:
![]()
Оскільки невідома речовина прореагувала повністю з H2SO4, то кількість невідомої речовини становить 0,2 моль. Розраховуємо кількість речовини KCl, CaS, ScP у 14,9 г.
М(KCl) = 74,5 г/моль; n(KCl) = m(KCl) / M(KCl) = 14,9 /74,5 = 0,200 (моль)
М(СaS) = 72 г/моль; n(СaS) = m(СaS) / M(СaS) = 14,9 /72 = 0,207 (моль)
М(ScP) = 76 г/моль; n(ScP) = m(ScP) / M(ScP) = 14,9 /76 = 0,196 (моль)
Отже, невідома речовина – KCl (калій хлорид)
5. Рівняння відповідної реакції:
KClтв. + H2SO4 → НCl↑ + KHSO4
6. Сіль, яка утворюється в результаті реакції – калій гідрогенсульфат (KHSO4)
Знаходимо її масу за рівнянням реакції:
m(KHSO4) = n(KHSO4) ∙ M(KHSO4) = 0,2 ∙ 136 = 27,2 (г)
7. Складаємо рівняння реакції взаємодії водного розчину утвореної солі KHSO4 з Mg:
2KHSO4 + Mg = K2SO4 + MgSO4 + H2↑
- (15 балів) До складу газової суміші входять: азот − 60%; кисень та карбон(ІV) оксид. Відносна густина цієї суміші за гелієм 8.
- Знайдіть об’ємні частки компонентів у суміші.
- Чи зміниться густина цієї суміші за гелієм, якщо карбон(ІV) оксид замінити на пропан (С3Н8) з такою ж об’ємною часткою?
- Чи підніметься у повітря кулька, заповнена цією сумішшю газів?
- Які гази можна використати замість карбон(IV) оксиду такої ж об’ємної частки, щоб зменшити відносну густину цієї суміші за гелієм.
Розв’язування
- Нехай φ(О2) = х, тоді φ(СО2) = 1-0,6-х = 0,4-х
Молярна маса суміші складає M(сум.) = DH2·M(He) = 8·4=32 г/моль
Складаємо алгебраїчне рівняння: 0,6·28+32х+44(0,4-х)=32. Звідки х=0,2.
Отже φ(О2) = 0,2=20%, φ(СО2) = 0,4-0,2 = 0,2=20%
- Густина не зміниться оскільки пропан має таку ж саму масу, як і вуглекислий газ.
- Молярна маса суміші більша за середню молярну масу повітря (29), отже кулька не підніметься у повітря.
- Ті гази, які мають менші молярні маси ніж вуглекислий газ: водень, гелій, амоніак, азот…


про публікацію авторської розробки
Додати розробку
