Олімпіада з хімії 9 клас (запитання та відповіді)
Кожен вчитель-предметник прагне навчити дітей, підготувати до конкурсів, олімпіад...Саме тому у пригоді стануть завдання вже з відповідями для підготовки . Бажаю всім успіхів у підготовці до олімпіади.
9 клас
У завданнях 1-5 виберіть правильну відповідь
1. (5 балів) Визначте правильність тверджень щодо кислотно-оснóвних індикаторів.
I. Індикаторами визначають наявність будь-якого електроліту в розчині.
II. Індикатори змінюють забарвлення залежно від концентрації в розчині йонів H + і ОН –
III. За наявності кислоти фенолфталеїн має малинове забарвлення.
IV.
За наявності нерозчинних гідроксидів індикатори не змінюють забарвлення через дуже малий ст
упінь дисоціації.
V. Усі індикатори в кислотному середовищі набувають червоного забарвлення.
А. правильні лише I та III твердження
Б. правильні лише IІ та IV твердження
В. правильні лише IIІ та V твердження
Г. правильні лише I, IIІ та V твердження
2. (5 балів) У двох посудинах містяться водні розчини масою 125 г кожний з масовою часткою солі 20 %
за температури 25 °С. До вмісту кожної посудини добавили порцію відповідної солі масою 13 г,
підтримуючи температуру 25 °С (див. рисунок). Візьміть до уваги, що втрат води не було.
Проаналізуйте твердження щодо розчинів, які утворилися. Використайте наведені в таблиці дані щодо
розчинності солей у воді за цих умов.
I. За температури 25 °С ненасиченими будуть розчини в обох посудинах.
II. За температури 25 °С ненасиченим буде розчин лише в посудині 1.
Чи є поміж них правильні?
А. правильне лише І; Б. правильне лише II; В. обидва правильні; Г. немає правильних.
3. (5 балів) Троє учнів — Василь, Ганна й Вікторія — на уроці з фізичних властивостей речовин
обговорювали взаємозв’язок запаху речовин із їх будовою. Визначте правильність їх суджень.
Василь: Запах може бути лише в речовин молекулярної будови.
Ганна: Ванілін — тверда речовина, але має запах унаслідок своєї леткості.
Вікторія: Якщо речовина має запах, то вона має легко випарюватися.
А. мають рацію лише Василь і Ганна
Б. мають рацію лише Василь і Вікторія
В. мають рацію лише Ганна й Вікторія
Г. усі троє учнів мають рацію
4. (5 балів) Позначте назву оксиду, якому відповідає хімічна формула СrO 2 :
А. хром(ІІ) оксид; Б. хром(ІІІ) оксид; В. хром(ІV) оксид; Г. хром(І) оксид.
5. (5 балів) Вкажіть правильні твердження щодо одноосновної кислоти, у водному розчині якої на кожні 95
недисоційованих молекул припадає 10 йонів:
А. при додаванні до розчину сильної кислоти ступінь дисоціації
Б. розчин кислоти не проводить електричний струм
В. ступінь дисоціації кислоти становить 10%
Г. ступінь дисоціації кислоти становить 5%
Д. розчин кислоти проводить електричний збільшується струм
До завдань 6-10 наведіть повні розв’язки та пояснення.
6. (15 балів) Осад А синього кольору нейтралізували безбарвною речовиною Б з утворенням
блакитного розчину В. При випаровуванні розчину В і прожарюванні осаду утворюються: газ бурого
кольору Г, безкольоровий газ Д, який утворюється під час фотосинтезу, і тверда речовина Е
чорного кольору, яка може вступати в реакцію з речовиною Б, з утворенням речовини В.
1) Визначте речовини А, Б, В, Г і Е.
2) Складіть рівняння відповідних реакцій. Для реакцій йонного обміну запишіть молекулярні та
йонно молекулярні рівняння.
3) Для реакції, яка відображає процес прожарювання осаду, складіть електронний баланс,
укажіть окисник та суму коефіцієнтів після реакції.
7. (15 балів) При взаємодії суміші газів карбон(ІІ) оксиду та карбон(ІV) оксиду, з відносною густиною за
воднем 20,4, та калій гідроксиду в розчині одержано 10 г калій гідрогенкарбонату. Практичний вихід
солі дорівнював 100%.
1) Обчисліть масу калій гідроксиду.
2) Встановіть об’ємні та масові частки газів у суміші.
2) Визначте об'єм суміші газів, виміряний за н.у., які використано для одержання солі.
8. (15 балів) Складіть рівняння реакцій за нижче наведеною схемою:
Mg → X → Y → М → Z → MgCO 3 → СО 2 → Na 2 СО 3
Виконайте завдання:
1) Визначте невідомі речовини X, Y, М, Z.
2) Дайте назви усім продуктам реакцій, укажіть типи хімічних реакцій.
3) Для реакції 2 напишіть йонно-молекулярні рівняння реакцій.
9. (15 балів) У середньому наш організм потребує 1,5 – 2 літри речовини Х на день. У наведених далі
українських народних загадках іде мова про одну й ту ж хімічну речовину Х у різних агрегатних станах: а)
В огні не горить і у воді не тоне; б) Без рук, без ніг, усе біжить; в) Текло, текло і лягло під скло.
1) Про яку речовину йдеться в загадках, у яких агрегатних станах? Поясніть явище, описане в
першій загадці: чому не тоне у воді?
2) До якого класу сполук належить речовина Х? Як речовину Х треба було б називати згідно з
міжнародною номенклатурою?
3) Яка будова молекули цієї речовини? Поясніть, чому молекула речовини Х має саме таку будову?
4) У лабораторії можна одержати "важку" речовину Х. Поясніть, що це таке − "важка Х"?
5) Укажіть, із якими з наведених речовин: КОН; SO 3 ; Са; Fe; NaH; графіт − реагуватиме речовина
Х. Напишіть рівняння цих реакцій з обов’язковим зазначенням умов, за яких вони можуть відбуватися.
10. (15 балів) Суміш алюмінію та оксиду невідомого двовалентного металу обробили надлишком розчину
лугу, маса суміші дорівнювала 39 г. Унаслідок реакції виділився газ, у результаті спалювання якого на
повітрі утворилася вода масою 27 г. Для розчинення твердої речовини, що залишилася після обробки
суміші розчином лугу, знадобилося 25,2 см 3 розчину хлоридної кислоти з масовою часткою 36,5 % (ρ = 1,19
г/см 3 ).
1) Визначте масу гідроген хлориду, що міститься у зазначеному в задачі розчині хлоридної кислоти.
2) Встановіть оксид невідомого металу.
3) Яким чином можна виділити із цього оксиду метал? Який колір має цей метал?
ВІДПОВІДІ
У завданнях 1-5 виберіть правильну відповідь
- (5 балів) Визначте правильність тверджень щодо кислотно-оснóвних індикаторів.
I. наявніст визначають Індикаторамирозчині. в електроліту будь-якого ь
II. концентрації від залежно забарвлення змінюють Індикатори H йонів розчині в+ ОН і –
III. забарвлення. малинове має фенолфталеїн кислоти наявності За
IV. дисоціації. ступінь малий дуже через забарвлення змінюють не індикатори гідроксидів нерозчинних наявності За
V. набувають середовищі кислотному в індикатори Усі забарвлення. червоного
А. твердження III та I лише правильні
Б. твердження IV та IІ лише правильні
В. твердження V та IIІ лише правильні
Г. твердження V та IIІ I, лише правильні
- (5 балів) У двох посудинах містяться водні розчини масою 125 г кожний з масовою часткою солі 20 % за температури 25 °С. До вмісту кожної посудини добавили порцію відповідної солі масою 13 г, підтримуючи температуру 25 °С (див. рисунок). Візьміть до уваги, що втрат води не було.
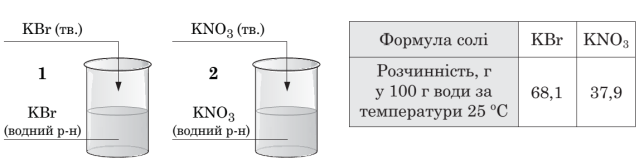
Проаналізуйте твердження щодо розчинів, які утворилися. Використайте наведені в таблиці дані щодо розчинності солей у воді за цих умов.
- За температури 25 °С ненасиченими будуть розчини в обох посудинах.
- За температури 25 °С ненасиченим буде розчин лише в посудині 1.
Чи є поміж них правильні?
А. правильне лише І; Б. правильне лише II; В. обидва правильні; Г. немає правильних.
- (5 балів) Троє учнів — Василь, Ганна й Вікторія — на уроці з фізичних властивостей речовин обговорювали взаємозв’язок запаху речовин із їх будовою. Визначте правильність їх суджень.
Василь: Запах може бути лише в речовин молекулярної будови.
Ганна: Ванілін — тверда речовина, але має запах унаслідок своєї леткості.
Вікторія: Якщо речовина має запах, то вона має легко випарюватися.
А. Ганна і Василь лише рацію мають
Б. Вікторія і Василь лише рацію мають
В. Вікторія й Ганна лише рацію мають
Г. рацію мають учнів троє усі
4. (5 балів) Позначте назву оксиду, якому відповідає хімічна формула СrO2:
А. хром(ІІ) оксид; Б. хром(ІІІ) оксид; В. хром(ІV) оксид; Г. хром(І) оксид.
5. (5 балів) Вкажіть правильні твердження щодо одноосновної кислоти, у водному розчині якої на кожні 95 недисоційованих молекул припадає 10 йонів:
|
А. при додаванні до розчину сильної кислоти ступінь дисоціації збільшується |
Б. розчин кислоти не проводить електричний струм |
В. ступінь дисоціації кислоти становить 10% |
Г. ступінь дисоціації кислоти становить 5% |
Д. розчин кислоти проводить електричний струм |
6. (15 балів) Осад А синього кольору нейтралізували безбарвною речовиною Б з утворенням блакитного розчину В. При випаровуванні розчину В і прожарюванні осаду утворюються: газ бурого кольору Г, безкольоровий газ Д, який утворюється під час фотосинтезу, і тверда речовина Е чорного кольору, яка може вступати в реакцію з речовиною Б, з утворенням речовини В.
1) Визначте речовини А, Б, В, Г і Е.
2) Складіть рівняння відповідних реакцій. Для реакцій йонного обміну запишіть молекулярні та йонно молекулярні рівняння.
3) Для реакції, яка відображає процес прожарювання осаду, складіть електронний баланс, укажіть окисник та суму коефіцієнтів після реакції.
Розв’язування
1) Осад А – Cu(OH)2. Безбарвна речовина Б – HNO3. Речовина В Cu(NO3)2 - розчин має блакитний колір.
Cu(OH)2 + 2HNO3= Cu(NO3)2 + 2H2O
При прожарюванні кристалів цієї солі утворюється три речовини:
CuO – речовина Е чорного кольору
NO2 – газ Г бурого кольору,
O2 – безбарвний газ Д, який утворюється під час фотосинтезу.
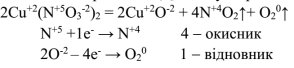
Окисник Нітроген, сума коефіцієнтів після реакції - 7.
Речовина Е реагує з речовиною Б з утворенням речовини В, отже рівняння:
CuO + 2HNO3= Cu(NO3)2+ H2O
7. (15 балів) При взаємодії суміші газів карбон(ІІ) оксиду та карбон(ІV) оксиду, з відносною густиною за воднем 20,4, та калій гідроксиду в розчині одержано 10 г калій гідрогенкарбонату. Практичний вихід солі дорівнював 100%.
1) Обчисліть масу калій гідроксиду.
2) Встановіть об’ємні та масові частки газів у суміші.
2) Визначте об'єм суміші газів, виміряний за н.у., які використано для одержання солі.
Розв’язування
1. Записуємо рівняння реакції: КОН + СО2 → КНСО3, бо з калій гідроксидом реагує лише СО2.
2. Обчислюємо масу калій гідроксиду:
n(KHCO3) = m/M = 10г / 100г/моль = 0,1моль
n(KHCO3) = n(KOH) = 0,1моль
m(KOH) = n∙М = 0,1моль ∙ 56г/моль = 5,6 г
3. Обчислюємо об'єм СО2, оскільки лише він бере участь у реакції з КОН:
n(KHCO3) = n(СО2) = 0,1моль
V(CO2) = n∙Vm = 0,1моль ∙ 22,4л/моль = 2,24 л
4. Знаходимо середню молярну масу суміші газів:
Мсер. = 2∙DH2 = 2 ∙ 20,4 = 40,8 г/моль
5. Знаходимо об’ємну частку вуглекислого газу в суміші:
Мсер. = М(СО2) ∙ φ(СО2) + М(СО) ∙ φ(СО)
Нехай φ(СО2) = х, а φ(СО) = (1-х), тоді 40,8 = 44х + 28(1 – х)
40,8 = 44х + 28 – 28х
12,8 = 16х
х = 0,8, отже φ(СО2) = 80%
6. Знаходимо об'єм суміші газів
φ(СО2) = V(СО2) / Vсум., отже Vсум. = V(СО2) / φ(СО2)
Vсум. = 2,24л / 0,8 = 2,8 л
Відповідь: для одержання солі використано 5,6 г КОН та 2,8 л суміші СО2 і СО.
8. (15 балів) Складіть рівняння реакцій за нижче наведеною схемою:
Mg → X → Y → М → Z → MgCO3 → СО2→ Na2СО3
Виконайте завдання:
1) Визначте невідомі речовини X, Y, М, Z.
2) Дайте назви усім продуктам реакцій, укажіть типи хімічних реакцій.
3) Для реакції 2 напишіть йонно-молекулярні рівняння реакцій.

9. (15 балів) У середньому наш організм потребує 1,5 – 2 літри речовини Х на день. У наведених далі українських народних загадках іде мова про одну й ту ж хімічну речовину Х у різних агрегатних станах: а) В огні не горить і у воді не тоне; б) Без рук, без ніг, усе біжить; в) Текло, текло і лягло під скло.
1) Про яку речовину йдеться в загадках, у яких агрегатних станах? Поясніть явище, описане в першій загадці: чому не тоне у воді?
2) До якого класу сполук належить речовина Х? Як речовину Х треба було б називати згідно з міжнародною номенклатурою?
3) Яка будова молекули цієї речовини? Поясніть, чому молекула речовини Х має саме таку будову?
4) У лабораторії можна одержати "важку" речовину Х. Поясніть, що це таке − "важка Х"?
5) Укажіть, із якими з наведених речовин: КОН; SO3; Са; Fe; NaH; графіт − реагуватиме речовина Х. Напишіть рівняння цих реакцій з обов’язковим зазначенням умов, за яких вони можуть відбуватися.
Розв’язування
Речовина Х – вода. Вказано агрегатні стани, пояснено, чому лід не тоне у воді.
Вода - оксид, а її назва за номенклатурою – гідроген оксид.
Важка вода (D2O) – вода, до складу якої водить два атоми стійкого ізотопу Гідрогену – дейтерію ( 21D).
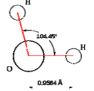
Будова молекули води.
Атом Оксигену у молекулі води перебуває у стані sр3 -гібридизації. Експериментально встановлено, що валентні кути у молекулі Н2О дорівнюють 104,5°. Таке відхилення у значенні валентних кутів молекул Н2О від 109°27 (теоретичний для тетраедричного розташування sр3 - орбіталей) спричинене наявністю неподілених електронних пар атома Оксигену: у молекулі Н2О на чотири sр3 -гібридизовані орбіталі припадає шість електронів. Дві електронні пари залишаються неподіленими, тобто належать атому Оксигену. Орбіталі з неподіленими парами електронів розміщуються близько до ядра і тому сильно взаємно відштовхуються. Це збільшує асиметричність розподілу електронної густини навколо атома Оксигену і зменшує валентний кут порівняно з тетраедричним. Отже, молекула води – це диполь.
КОН розчиняється у воді, але не взаємодіє.
SO3 + H2O =H2SO4 (звичайні умови, розчин нагрівається);
Ca + 2H2O = Ca(OH)2 + H2 (звичайні умови, розчин нагрівається);
Fe +H2O = FeO + H2, або 3Fe +4 H2O = Fe3O4 + 4 H2 (температура 500-800 С);
C+H2O = CO + H2 (температура 800 – 1000 С);
NaH + H2O = NaOH +H2 (бурхливо реагує з водою, із виділенням тепла)
10. (15 балів) Суміш алюмінію та оксиду невідомого двовалентного металу обробили надлишком розчину лугу, маса суміші дорівнювала 39 г. Унаслідок реакції виділився газ, у результаті спалювання якого на повітрі утворилася вода масою 27 г. Для розчинення твердої речовини, що залишилася після обробки суміші розчином лугу, знадобилося 25,2 см3 розчину хлоридної кислоти з масовою часткою 36,5 % (ρ = 1,19 г/см3).
1) Визначте масу гідроген хлориду, що міститься у зазначеному в задачі розчині хлоридної кислоти.
2) Встановіть оксид невідомого металу.
3) Яким чином можна виділити із цього оксиду метал? Який колір має цей метал?
Розв’язування
- Визначаємо масу гідроген хлориду у його розчні:
mр-ну(HCl) = V· = 25,2·1,19 = 30 г.
Тоді масу HCl знаходимо таким чином: m(HCl) = mр-ну(HCl)·(HCl) = 30·0,365 = 10,95 г.
- Газ, що утворюється при взаємодії суміші – це водень.
- 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
- 2H2 + O2= 2H2O
З рівняння 2) видно, що n(H2) = n(H2O) = 27/18 = 1,5 моль.
З рівняння 1) n(Al) = 2/3n(H2) = 1 моль. Тоді m(Al) = 27 г.
Знаходимо масу оксиду МеО: m(MeO) = 39 – 27 = 12 г.
MeO + 2HCl = MeCl2 + H2O
Із рівняння видно, що n(MeO) = 1/2n(HCl) = 10,95/(36,5·2) = 0,15 моль.
Знайдемо молярну масу оксиду: M(MeO) = m/n = 12/0,15 = 80 г/моль.
Тоді атомна маса металу складає 80 – 16 = 64. Це Купрум Сu.
- Метал із його оксиду можна відновити воднем. Метал має жовто-червоне (рожеве) забарвлення.
СuO + H2 = Cu + H2O.
-
Дякую за розробку


про публікацію авторської розробки
Додати розробку
