Урок "Відносна молекулярна маса речовини, її обчислення за хімічною формулою"
Урок з хімії, 7 клас. Тип уроку: вивчення нового матеріалу.
Методи і методичні прийоми:
• словесний (бесіда, розповідь, робота з підручником, періодичною системою хімічних елементів, складання опорного конспекту, виконання тренувальних вправ),
Тема. Відносна молекулярна маса речовини, її обчислення за хімічною формулою.
Мета уроку:
- поглибити поняття про хімічну формулу, її використання для розрахунків;
- дати поняття про відносну молекулярну масу речовини;
- формувати вміння й навички обчислювання за хімічними формулами;
- навчити визначати відносну молекулярну масу простих і складних речовин за їх формулами;
- розвивати логічне мислення,
- розвивати вміння та навички проводити обчислення за хімічними формулами
- виховувати інтерес до вивчення хімії.
Тип уроку: вивчення нового матеріалу.
Методи і методичні прийоми:
• словесний (бесіда, розповідь, робота з підручником, періодичною системою хімічних елементів, складання опорного конспекту, виконання тренувальних вправ),
Обладнання: періодична система хімічних елементів Д.І. Менделєєва.
Базові поняття та терміни: відносна атомна маса, відносна молекулярна маса, молекулярна маса, відносна формульна маса.
Епіграф уроку: Чого б ти не навчався, ти навчаєшся для себе. Петроній
Хід уроку
І.Організаційний момент.
ІІ. Актуалізація опорних знань учнів
(дидактична гра з взаємоперевіркою)
І варіант
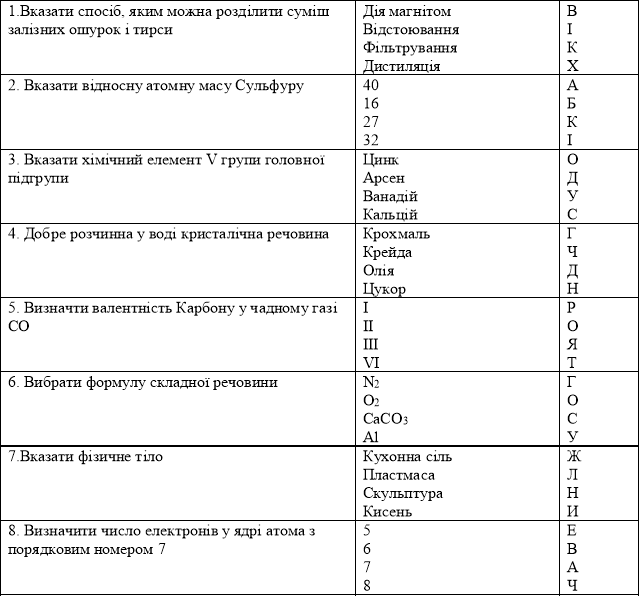 ІІ варіант ( відносна)
ІІ варіант ( відносна)
|
1. Чому дорівнює відносна атомна маса Кальцію |
З2 40 16 23 |
К М Ц У |
|
2. Вказати назву хімічного елемента головної підгрупи ІІ групи |
Цинк Калій Магній Хлор |
П Н О Х |
|
3.Найбільш точним мірним приладом є: |
Мірна колба Мірний стакан Мірна піпетка |
Ю К Л |
|
4. Вказати фізичну властивість крейди, що відрізняє її від піску |
Запах Блиск Смак колір |
А В С Е |
|
5. Визначити число електронів в атомі елемента з порядковим номером 16 |
32 16 6 42 |
Г К Р Я |
|
6. До металів належить: |
Хлор Кисень Фосфор магній |
Д Т Щ У |
|
7. Визначити валентність Хрому у Cr2O3 |
II I III VI
|
Ч К Л Ж |
|
8. Вибрати формулу простої речовини |
K2 O N2 CuSO4 CaCO3 |
Б А Г Ц |
(молекула)
ІІІ варіант
|
1. Вибрати формулу складної речовини |
H2O N2 O2 Zn |
М Р Ь К |
|
2. Вказати відносну атомну масу Оксигену |
32 16 11 8 |
З А У Т |
|
3.Визначити валентність Магнію у MgO |
ІІІ І ІІ IV |
I М С Я
|
|
4. Визначити число електронів у ядрі атома елемента з порядковим номером 20 |
40 13 20 11 |
Ї О А Ц |
(маса)
Діти, про що вам говорять ці слова? Молекула має масу ІІІ. Мотивація навчальної діяльності.
Маса молекули як і атома дуже мала. Тому користуватися нею при обчисленнях незручно, тому ввели поняття відносна молекулярна маса. Отже ,тема нашого уроку « Відносна молекулярна маса». (СЛАЙД 1)
Я хочу прочитати уривок з твору Л.Керролла "Аліса в Країні чудес": "За кілька кроків від неї сидів на гілці Чеширський кіт. - "Скажіть, будь- ласка , куди мені звідси йти?" - "А куди ти хочеш потрапити?"- спитав у відповідь кіт.
- "Мені все одно..."- сказала Аліса.
"Тоді все одно куди йти" - зауважив кіт.
Що хоче сказати цим кіт Алісі та навіщо я прочитала ці слова ?
Так правильно , потрібно знати мету своєї роботи. І сьогодні на уроці наше завдання вивчити що таке Mr , навчитись її визначати за хімічними формулами і цим збагатити свої знання з хімії . Величини відносних молекулярних мас широко використовують у різних хімічних, фізичних і хіміко – технічних розрахунках. Тому важливо вміти їх обчислювати.
Тому постарайтесь сьогодні хоча б подумки , а іноді й уголос , починати свою відповідь словами : "А от я зрозумів ..." . Тож до роботи , друзі!
ІІІ. Вивчення нового матеріалу
1. Робота з підручником с 48 (запитання надруковані і даються кожному)
- як позначається відносна молекулярна маса?
- чому дорівнює відносна молекулярна маса?
- Як обчислити відносну молекулярну масу?
- (робота з словником) Відносна молекулярна маса – це фізична величина, що показує в скільки разів маса певної молекули більша за 1\12 маси атома Карбону
(СЛАЙД 2)
2. Обчислимо відносні молекулярні маси речовин, моделі яких є на столі (робота на дошці)
Н2О (18), Н2О2 (34), СО2 (44), Н2СО3 (62), N2 (28), NH3 (17)
3. (індивідуальна робота) У вас на столах знаходяться речовини, кожна з яких має хімічну формулу. Ваше завдання визначити Mr цих речовин, дотримуючись правил БЖД при роботі з хімічними речовинами.
4.Хімічне лото. (робота в парах) У вас є лото-білети, у яких зазначені числа. Серед них є і відносні молекулярні маси речовин, що записані у вас на лото-папері. Знайти їх.
5. Експерти в галузі харчування , медицини, астрономії (з бейжиками)
Фізіолог харчування
У харчовій промисловості широко застосовують етанову кислоту. Її традиційна назва оцтова кислота.. Цю речовину використовують при консервуванні та як смакову приправу. Формула оцтової кислоти СН3СООН. Відносна молекулярна маса - 60.
Цінним харчовим продуктом є і цукор. Молекулярна формула С12Н22О11. Відносна молекулярна маса - 342 . Цукрове виробництво розпочалося в Україні в 1802 році.
Лікар. Формула гемоглобіну крові – С3032Н4816N780О872S8Fe4. Відносна молекулярна маса його – 64900.
Етиловий спирт – С2Н5ОН використовується в медицині для дезинфекції. Відносна молекулярна маса цієї речовини – 46. Коли готуються зробити укол чи взяти кров на аналіз, шкіру протирають ватою, змоченою в етанолі. Це отруйна речовина, що згубно впливає на організм людини, виявляє наркотичну дію, викликає залежність що призводить до захворювання на алкоголізм. Етанол порушує нервову систему і память.
Астроном. На Місяці відсутні вода Н2О і кисень О2. Відносна молекулярна маса води – 18. а кисню – 32.
На Сонці масова частка водню, формула якого Н2. а відносна молекулярна маса – 2, становить – 70%.
Озоновий шар, що складається з озону О3 і має відносну молекулярну масу 48 , відіграє значну роль у збереженні життя на нашій планеті.
6.Лист від виробника напою «Кока-кола» (в конверті).
ДО СКЛАДУ НАПОЮ «КОКА-КОЛА» ВХОДЯТЬ ВОДА Н2О (18), ВУГЛЕКИСЛИЙ ГАЗ СО2 (44), КАРБОНАТНА (ВУГІЛЬНА) Н2СО3 (62) ТА ФОСФАТНА Н3РО4 (98) КИСЛОТИ, САХАРОЗА (ЦУКОР) С12Н22О11 ( 342 ), КОФЕЇН С8Н10N4О2 (194). ОБЧИСЛИТИ ВІДНОСНІ МОЛЕКУЛЯРНІ МАСИ СПОЛУК І РОЗТАШУВАТИ ФОРМУЛИ РЕЧОВИН ЗА ЗМЕНШЕННЯМ МАС ЇХНІХ МОЛЕКУЛ
ІV. Узагальнення та закріплення знань Вправа «Розслідування ведуть знавці»
Задача. Відносна атомна маса елемента А у 1,4375 раза більша , ніж відносна атомна маса елемента В. Сума відносних атомних мас елементів А і В складає 39. Назвати елементи А і В, скласти формулу сполуки АВ, обчислити відносну молекулярну масу речовини АВ.
В – х. тоді А- 1,4375х.
х+1.4375х=39
2,4375х=39
Х=16 -Оксиген
1/ 6.1,4375=23 – Натрій Na2O (62)
Кросворд
|
|
1. Х |
І |
М |
І |
Я |
||||||
|
2. Н |
І |
Т |
Р |
О |
Г |
Е |
Н |
|
|||
|
|
3. А |
Л |
Ю |
М |
І |
Н |
І |
Й |
|||
|
4. А |
З |
О |
Т |
|
|||||||
|
5. О |
Д |
И |
Н |
|
|||||||
|
|
6. М |
О |
Л |
Е |
К |
У |
Л |
А |
|
||
|
7. Ф |
Р |
А |
Н |
Ц |
І |
Й |
|
||||
|
|
8. С |
І |
Л |
Ь |
|
||||||
- Наука про речовини та їх перетворення
- Хімічний елемент. відносна атомна маса якого 14.
- Я живу в квартирі № 13
- N2 – це…
- Валентність Гідрогену
- Найменша частинка речовини. що зберігає її властивості.
- Хімічний елемент І групи головної підгрупи.
- Її возили чумаки з Криму.
VІ Підведення підсумків уроку.
• Закінчити речення очікувань:
1. Я знаю, що відносна молекулярна маса речовини – це __________________________.
2. Я знаю, що відносна молекулярна маса позначається ___________________________ .
3. Я знаю, що для того, щоб розрахувати відносну атомну масу речовини необхідно ________________________________________ .
4. Я знаю, що відносну атомну масу кожного елемента можна знайти в _____________ .
5. Я знаю, що мені потрібно вміти обчислювати відносну атомну масу речовини, для того, щоб __________________________________ .
VIІ Домашнє завдання.
1) Опрацювати матеріал підручника Параграф 7
2) Виконати завдання 7 с.48 3) додаткове завдання Підготувати повідомлення «Молекули-гіганти» ІV рівень


про публікацію авторської розробки
Додати розробку
