Опорный конспект для учащихся "Соединения неметаллических элементов с гидрогеном. Хлороводород. Хлоридная кислота"
Опорный конспект может быть использован учителем при дистанционном обучении, а также учащимися при подготовке к государственной итоговой аттестации и внешнему независимому оцениванию.
Галогеноводороды (HGal) - это газы (исключение - HF - жидкость), с резким запахом, очень токсичны, хорошо растворимы в воде. Так, например, в одном объёме воды растворяется 517 объёмов газообразного хлористого водорода. Атом галогена в галогеноводороде находится в низшей степени окисления, поэтому галогеноводороды - восстановители. Атомы галогена и водорода в молекуле галогеноводородов связаны между собой ковалентной полярной связью, кристаллическая решётка в соединениях - молекулярная.
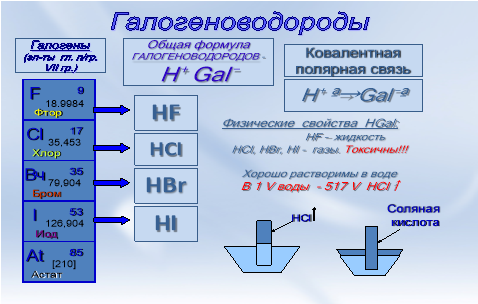
Для соединений с молекулярной кристаллической решёткой характерны летучесть и наличие ковалентной связи.
В ряду HF - HCI - HBr - HI уменьшается прочность молекул, так как увеличивается радиус атома галогена, уменьшается его ЭО. Отсюда сила кислот, образуемых при растворении галогеноводородов в воде, увеличивается: самая сильная кислота в этом ряду - HI.
Сила раствора кислоты зависит от концентрации катионов водорода в растворе.
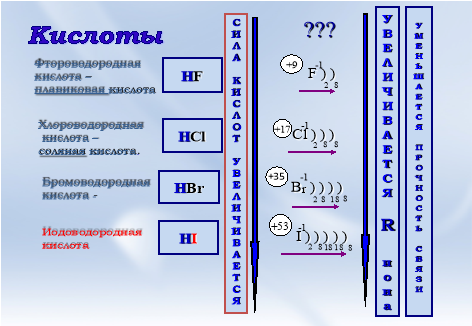
Хлороводород и соляная кислота
Хлороводорода и соляная кислота являются наиболее технически важными соединениями в химической промышленности.
Хлороводород HCI - это бесцветный газ с резким неприятным запахом, тяжелее воздуха. Он относится к числу наиболее растворимых в воде газов. В промышленности хлороводород получают синтезом из водорода и хлора:
H2 + CI2 = 2HCI.
В лабораторных условиях для получения хлороводорода используют реакцию, проводимую при нагревании:
2NaCI(крист) + H2SO4(конц) = 2HCI↑ + Na2SO4(крист).
Данная реакция происходит необратимо, т.к. образуется летучая HCI и уходит из зоны действия.
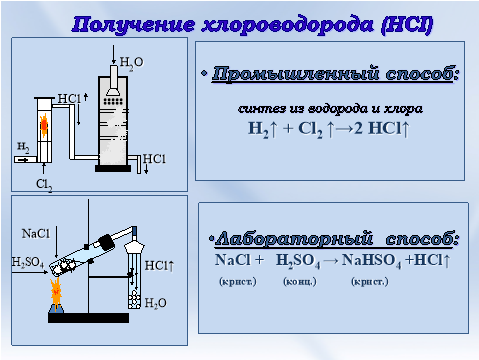
Хлоридная (хлороводородная, соляная) кислота HCI - водный раствор газа хлороводорода. Получают растворением хлороводорода в воде, раствор с концентрацией 36 - 38% называют концентрированным. Концентрированная соляная кислота НСI на воздухе "дымит" и имеет резкий запах, токсична.
Химические свойства хлоридной кислоты:
- Изменение окраски индикаторов:
Лакмус → красный
Метиловый оранжевый → ярко – розовый
- + Mе:
Zn + 2HCl → ZnCl2 + H2↑
![]() Если:
Если:
- Me стоит в ряду напряжений до водорода
- Me не является щелочным
- образуется растворимая соль
- + MexOy ( + амфотерные и основные оксиды)
HCl + CaO → СаCl2 + Н2О
HCl + CuO → СuCl2 + Н2О
- + Me(OH)n (основания)
HCl + NaOH → NaCl + Н2О
HCl + Cu(OH)2↓ → CuCl2 + Н2О
![]() Реакция с нерастворимыми основаниями протекает в том случае, если в результате реакции происходит растворение осадка.
Реакция с нерастворимыми основаниями протекает в том случае, если в результате реакции происходит растворение осадка.
- + Mex(кисл. ост.)y (соли)
![]()
![]() 2HCl + CaCO3 → CaCl2 + H2CO3
2HCl + CaCO3 → CaCl2 + H2CO3
CO2↑ H2O
![]() HCl + AgNO3 →AgCl +HNO3
HCl + AgNO3 →AgCl +HNO3
![]() Если:
Если:
- Выпадает осадок (↓)
- Выделяется газ (↑)
Соли галогеноводородных кислот – галогениды
Галогеноводородные кислоты образуют соли: фториды, хлориды, бромиды, иодиды. Все соли галогеноводородных кислот имеют ионный тип химической связи и, соответственно, ионную кристаллическую решётку.
Для веществ с ионной кристаллической решёткой характерными физическими свойствами являются прочность, но хрупкость.
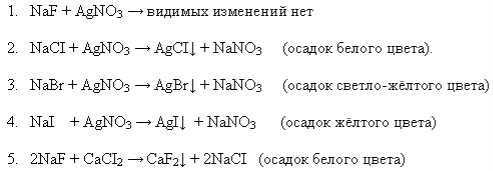
Для определения в растворе хлорид-, бромид-, и иодид-ионов используют реакцию с нитратом серебра. С помощью этого же реактива можно различить каждый ион, так в ходе реакции получаются разного цвета осадки.
![]() Качественные реакции на ионы галогенов – реакции с AgNO3.
Качественные реакции на ионы галогенов – реакции с AgNO3.
Качественные реакции на галогенид-ионы :


про публікацію авторської розробки
Додати розробку
