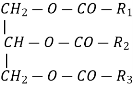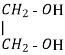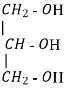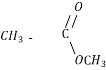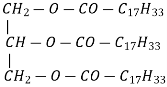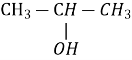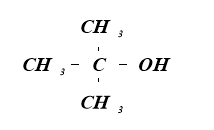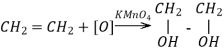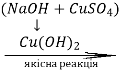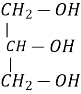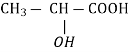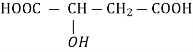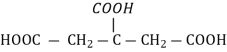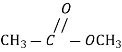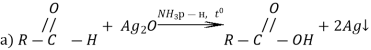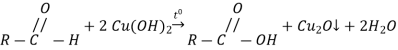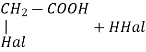Органічна хімія "Опорні конспекти: Спирти. Карбонові кислоти"
Гомологічні ряди оксигеновмісних органічних сполук
|
Насичені одноатомні спирти |
Насичені багатоатомні спирти |
Альдегіди |
Насичені карбонові кислоти |
Естери |
Жири |
Вуглеводи |
|
CnH2n+1OH
-ол |
CnH2n(ОH)2 CnH2n-1(ОH)3
-діол; -тріол |
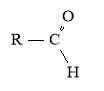
CnH2n+1СОH
-аль |
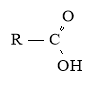
-ова к-та |
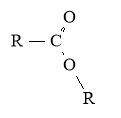
-оат |
|
Cn(H2O)n |
|
CH3OH-метанол
C2H5OH-етанол
C3H7OH- пропанол
C4H9OH- бутанол
C5H11OH- пентанол |
Двохатомний спирт – етиленгліколь, етандіол
трьохатомний спирт- гліцерин, пропантріол
|
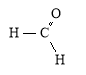
Метаналь, мурашиний, формальдегід
Етаналь, оцтовий, ацетальдегід
Пропаналь, пропіоновий |
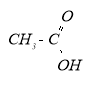
HCOOH Метанова к-та, мурашина
Етанова к-та, оцтова
Пропанова к-та, пропіонова
|
HCOOСH3 Метилметаноат, метиловий естер мурашиної к-ти
Метилетаноат, метиловий естер оцтової к-ти
Етилпропаноат, етиловий естер пропанової к-ти |
тристеарат
триолеат
|
Моносахариди C6H12O6 Глюкоза фруктоза
Дисахариди C12H22O11 Сахароза мальтоза
Полісахариди (С6H10O5)n Крохмаль целюлоза
|
1
|
Класифікація спиртів
|
||
|
Одноатомні |
Багатоатомні |
|
|
Двохатомні |
Трьохатомні |
|
|
R-OH; CnH2n+1OH
|
CnH2n(ОH)2
|
CnH2n-1(ОH)3 |
|
CH3OH-метанол
C2H5OH-етанол |
Двохатомний спирт – етиленгліколь, етандіол, етан – 1,2 - діол
|
трьохатомний спирт- гліцерин, пропантріол пропан – 1,2,3 - тріол
|
|
Одноатомні спирти
|
||
|
Первинні |
Вторинні |
Третинні |
|
CH3-CH2- CH2-OH пропан -1-ол пропанол - 1
|
пропан-2-ол пропанол - 2
|
2-метилпропан-2-ол 2-метилпропанол - 2
|
2
Одноатомні спирти
|
Загальна формула R-OH; CnH2n+1OH
|
Фізичні властивості |
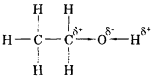
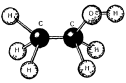
Будова молекули етанолу |
|
|
|
|
Хімічні властивості |
||
|
|
||
|
|
Способи добування |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
С6Н12О6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
3
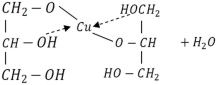
Багатоатомні спирти
|
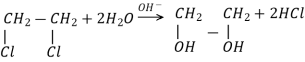
Методи добування етиленгліколю |
CnH2n (OH)2; CnH2n-1(OH)3 |
Хімічні властивості |
3CH2=CH2+4H2O+2KMnO4→3C H2OH- C H2OH+2MnO2+2KOH |
|
|
|
|
|
|
Методи добування гліцерину
відповідних алканів водним розчином лугу |
|
|
|
|
жири, масла |
|
|
|
||
|
2
|
4
Гомологічний ряд одноосновних насичених карбонових кислот
|
Радикал |
Формули
|
Назва за номенклатура
|
Температура |
Назва солей |
||
|
R- |
CnH2n+1COOH |
Тривіальна
|
Міжнародна IUPAC |
кипіння |
плавлення |
|
|
H- |
H-COOH |
Мурашина |
Метанова |
100,7 |
8,2 |
Форміат(метаноат) |
|
CH3- |
CH3-COOH |
Оцтова |
Етанова |
117,7 |
16,6 |
Ацетат(етаноат) |
|
CH3- CH2- |
CH3- CH2-COOH |
Пропіонова |
Пропанова |
140,8 |
-20,8 |
Пропіонат(пропаноат) |
|
C3H7- |
CH3- (CH2)2-COOH |
Масляна |
Бутанова |
163,3 |
-5,3 |
Бутират(бутаноат) |
|
C4H9- |
CH3- (CH2)3-COOH |
Валеріанова |
Пентанова |
186.4 |
-34,5 |
Валеріат(пентаноат) |
|
C5H11- |
CH3- (CH2)4-COOH |
Капронова |
Гексанова |
205,3 |
-3,9 |
Капронат(гексаноат) |
|
C6H13- |
CH3- (CH2)5-COOH |
Енантова |
Гептанова |
|
|
Енантоат(гептаноат) |
|
C11H23- |
CH3- (CH2)10-COOH |
Лауринова |
Додеканова |
|
|
Лауриноат |
|
C15H31- |
CH3- (CH2)14-COOH |
Пальмітинова |
Гексадекенова |
390 |
52,5 |
Пальміат |
|
C17H35- |
CH3- (CH2)16-COOH |
Стеаринова |
Октадекенова |
432 |
71,0 |
Стеарат |
|
|
|
|
|
|
|
|
Інші карбонові кислоти
|
Формули
|
Назва |
Назва солей |
|
C17H33-COOH
CH3- (CH2)7 |
Олеїнова , октадеценова вища жирна ненасичена кислота |
олеат |
|
C17H31-COOH
CH3 |
Лінолева вища жирна ненасичена кислота
|
лінолеат |
|
С6H5COOH |
Бензойна кислота, бензолкарбонова |
бензоат |
|
HOOC-COOH |
Щавлева , етандіолова |
оксалати |
5
Карбонові кислоти в природі
|
Назва |
Формула |
Місцезнаходження |
|
Мурашина
|
H-COOH |
Залози мурашок, бджолина отрута, кропива |
|
Оцтова |
CH3-COOH |
Кисле молоко, піт, сеча, деякі рослини |
|
Масляна
|
CH3- (CH2)2-COOH |
Погіркле вершкове масло |
|
Валеріанова |
CH3- (CH2)3-COOH |
Корінь валеріани |
|
Капронова |
CH3- (CH2)4-COOH |
Козячий жир |
|
Олеїнова |
C17H33-COOH |
Оливкова олія |
|
Щавлева
|
HOOC-COOH |
Щавель, ревінь |
|
Бурштинова
|
HOOC - CH2-CH2-COOH |
Бурштин, буре вугілля, деякі рослини |
|
Молочна |
|
Кисле молоко, сир, квашена капуста, силос; у м’язах накопичується під час їх роботи |
|
Яблучна |
|
Яблука, горобина, виноград |
|
Лимонна |
|
Цитрусові |
6
![]() Карбонові кислоти
Карбонові кислоти
Назва: Алкан +
|
|
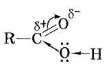
Будова молекули
|
Ізомерія.
1. Структурна
2. Міжкласова /подібність до складних естерів |
|
|
R – COOH
|
Фізичні властивості
|
Методи добування |
|
б) |
|||
2CH3-CH2-CH2-CH3+5O2 |
|||
2CH3COONa+H2SO4 |
|||
|
Хімічні властивості |
Застосування |
||
|
+Ме |
(R-COO)ΧMe+H2↑ |
|
|
|
+МеΧOY |
(R-COO) ΧMe+H2O |
||
|
+Ме(OH) Χ |
(R-COO) ΧMe+H2O |
||
|
солями слабких кислот |
(R-COO) ΧMe+ кислота |
||
|
+Hal2(Cl2;Br2)hν заміщення Гідрогену в радикалі |
|
||
|
+R1OH, H2SO4 естерифікація |
R-COOR1+H2O |
||
|
|
р-ція «срібного дзеркала для мурашиної к-ти» |
H-COOH+Ag2O |
|
7


про публікацію авторської розробки
Додати розробку