Тема уроку: ХАРАКТЕРИСТИКА ХІМІЧНИХ ЕЛЕМЕНТІВ МАЛИХ ПЕРІОДІВ ЗА ЇХНІМ МІСЦЕМ У ПЕРІОДИЧНІЙ СИСТЕМІ Й БУДОВОЮ АТОМА
Тема уроку: ХАРАКТЕРИСТИКА ХІМІЧНИХ ЕЛЕМЕНТІВ МАЛИХ ПЕРІОДІВ ЗА ЇХНІМ МІСЦЕМ У ПЕРІОДИЧНІЙ СИСТЕМІ Й БУДОВОЮ АТОМА
Цілі:
- Формування ключових компетентностей:
- саморозвитку й самоосвіти — створення проблемних ситуацій, уміння самостійно отримувати знання;
- інформаційної — відпрацювання вмінь робити висновки й узагальнення;
- соціально-трудової — вміти оперувати знаннями, розвивати гнучкість отриманих знань.
- Формування предметних компетентностей: навчитися характеризувати хімічні елементи малих періодів за їхнім місцем у періодичній системі й будовою атома; закріпити набуті знання про періодичну систему хімічних елементів, будову їхніх атомів, взаємозв’язок будови і властивостей елементів; закріпити навички написання електронних схем і формул будови атомів хімічних елементів, складання рівнянь реакцій, що характеризують їхні хімічні властивості.
Обладнання: Періодична система, таблиця «Будова електронних оболонок атомів І–ІІІ періодів».
Тип уроку: ВНМ (Д).
Форми роботи: самостійна робота по варіантах, робота в гетерогенних групах, прийоми «Творча лабораторія», складання схеми-шпаргалки, фронтальна робота біля дошки.
ХІД УРОКУ
І. ОРГАНІЗАЦІЯ КЛАСУ
ІІ. ОГОЛОШЕННЯ ТЕМИ Й МЕТИ УРОКУ
ІІІ. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ
1) Які речовини називають оксидами? На які групи вони поділяються?
2) Які речовини називають кислотами?
3) Які речовини називають основами?
Завдання: запишіть положення у Періодичній системі, повну будову атома (з протонами й нейтронами) наведеного хімічного елемента. Складіть формули його вищого оксиду й гідроксиду, що йому відповідає, вкажіть їхній характер.
ІІ варіант: елемент № 7.
IV варіант: елемент № 6.
IV. ЗАКРІПЛЕННЯ Й УЗАГАЛЬНЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
Прийом «Творчі лабораторії» (30 хв)
Учні сідають групами. Кожна група отримує картку з алгоритмом характеристики елемента.
Навчальний матеріал, який охоплює цей алгоритм, учні вже вчили. Отже, на цьому уроці ми його повторимо, розвинемо, узагальнимо й навчимося застосовувати на практиці в характеристиці хімічних елементів.
- Яка характерна властивість металів? (Взаємодія з неметалами)
- Яка характерна властивість неметалів? (Взаємодія з металами)
- Як основні оксиди реагують з водою?
- Як кислотні оксиди реагують з водою?
Все повторене можна узагальнити в схемі-шпаргалці.
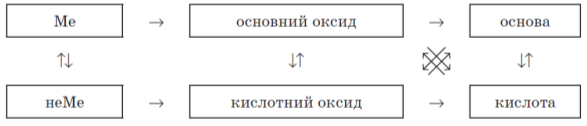
Наприклад: треба записати рівняння реакцій, які характеризують кислотний оксид. Дивимось у схему й бачимо, куди ведуть стрілки від кислотного оксиду — до основного оксиду й основи. Тобто записуємо рівняння реакцій за стрілками.
2) Алгоритм характеристики елемента
Діти використовують його на уроці, не переписують у зошит з метою економії часу. Його можна повісити у класі на стенді підготовки до уроку.
- назва елемента;
- відносна атомна маса елемента Ar;
- номер періоду (малий чи великий);
- номер групи (головна чи побічна підгрупа).
- знак хімічного елемента, протонне, нуклонне число;
- електронна схема, формула, графічний розподіл електронів по комірках;
- протони, нейтрони;
- кількість неспарених електронів;
- кількість електронів на зовнішньому шарі.
ІІІ. Властивості елемента і його сполук:
- проста речовина, формула, метал чи неметал;
- формула вищого оксиду, його характер;
- формула гідроксиду, що відповідає вищому оксиду, його характер;
- формула леткої сполуки з Гідрогеном (для неметалів);
- рівняння реакцій для простої речовини, вищого оксиду й гідроксиду.
Зразок характеристики елемента № 3
Літій, Ar (Li) = 7, ІІ період, малий, І група, головна підгрупа.
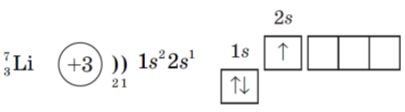
- протонів 3, нейтронів 4
- неспарений електрон 1
- на зовнішній оболонці 1 електрон
Літій, проста речовина літій, метал, вищий оксид Li2O, вищому оксиду відповідає основа LiOH, леткої водневої сполуки не утворює.
Рівняння реакцій складаємо, користуючись схемою-шпаргалкою.
1) 2Li + Cl2 → 2LiCl
2) 4Li + O2 → 2LiO2
3) Li2O + H2O → 2LiOH
Використовуючи цей алгоритм, пропонуємо учням дати характеристику елемента з протонним числом 6. Одночасно викликаємо до дошки сильного учня для виконання цього завдання з метою перевірки й корекції знань.
V. ПІДБИТТЯ ПІДСУМКІВ УРОКУ
VI. ДОМАШНЄ ЗАВДАННЯ


про публікацію авторської розробки
Додати розробку
