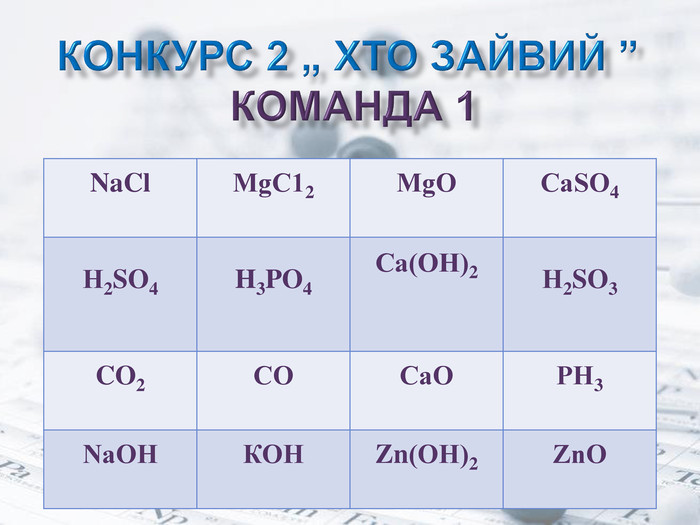
"Основні класи неорганічних сполук" - урок узагальнення знань, 8 клас
Про матеріал
Презентація до уроку узагальнення знань на тему "Основні класи неорганічних сполук". Урок проводиться у вигляді змагання між двома командами. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Дякую,дуже класно.
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку