Періодичний закон. Періодична система Д.І.Менделеєва
Про матеріал
Презентація до уроку хімії в 8 класі на тему "Періодичний закон Д. І. Менделєєва. Періодична система хімічних елементів, її структура. Значення періодичного закону" Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку






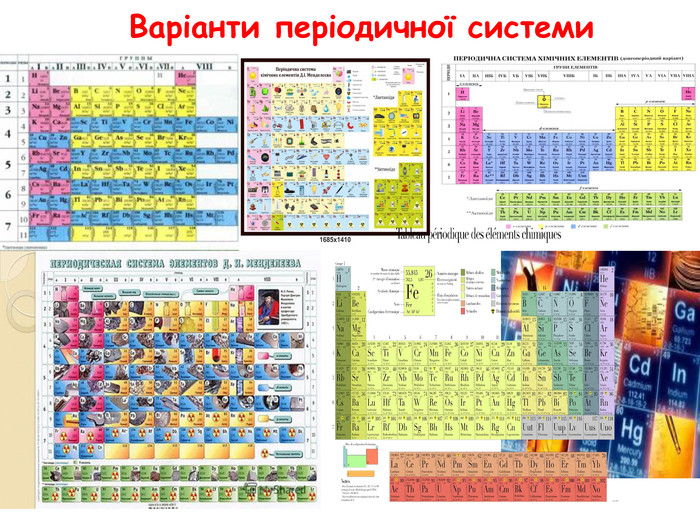
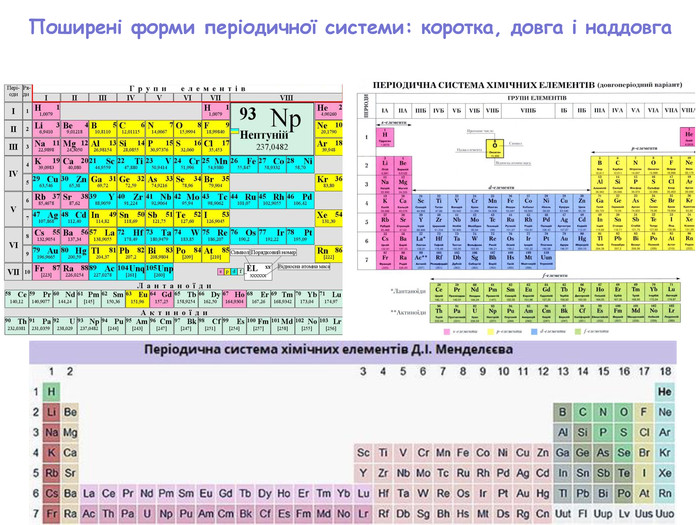

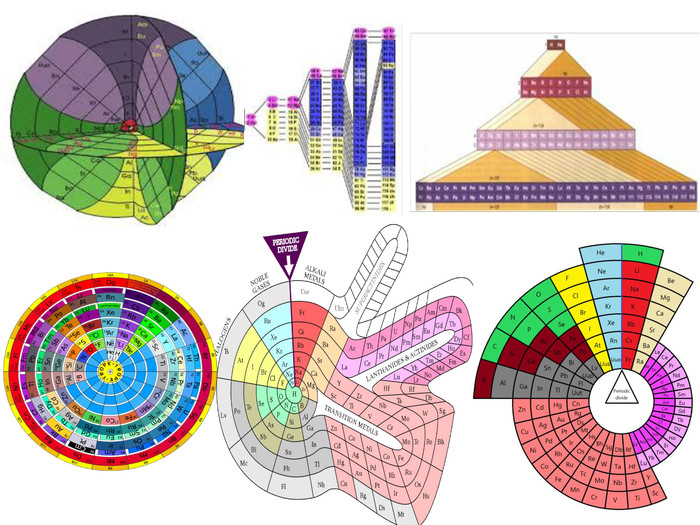

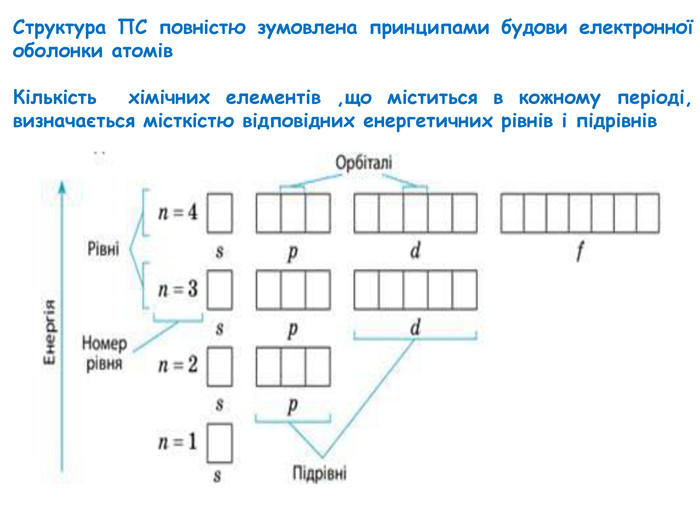
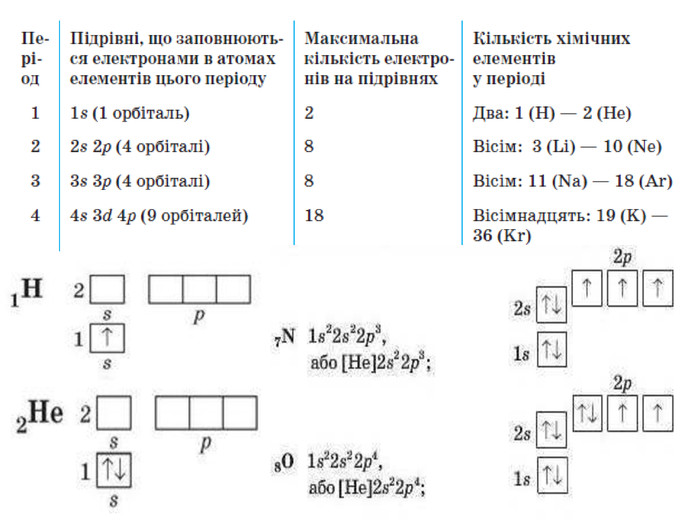
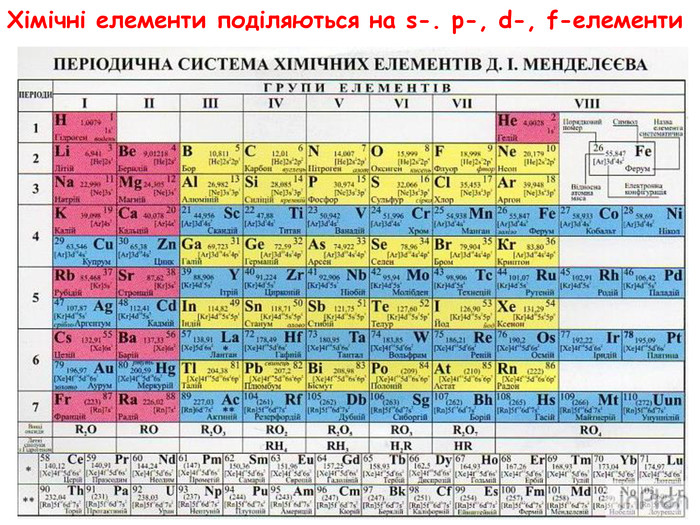
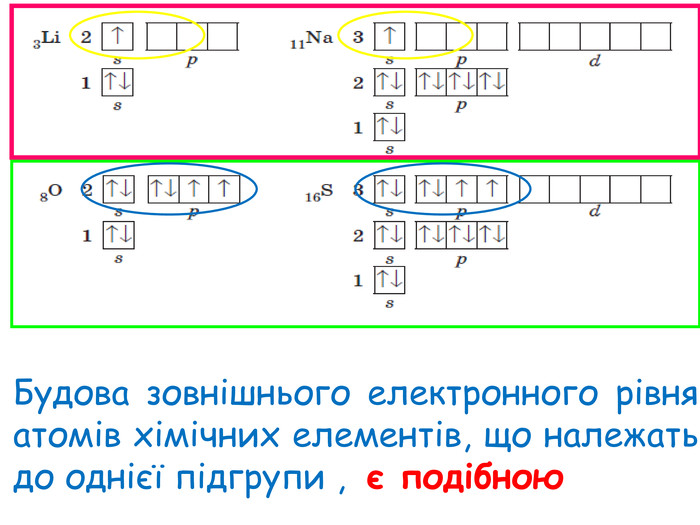
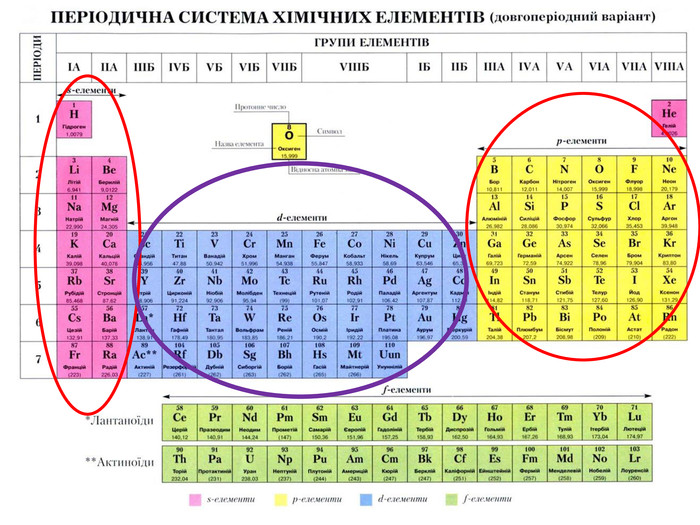
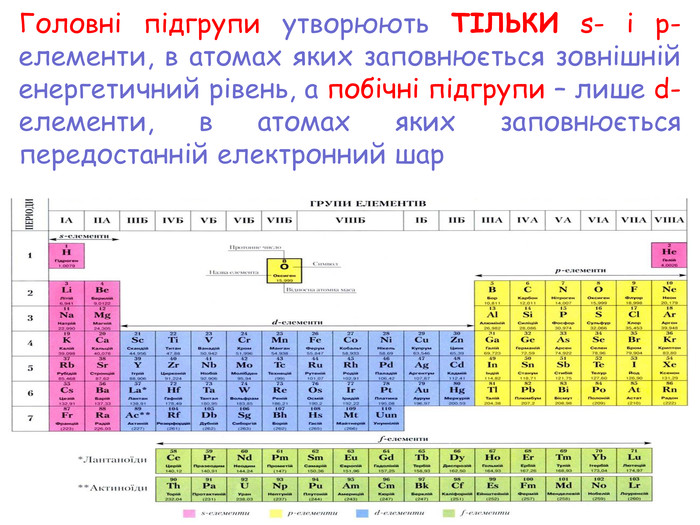

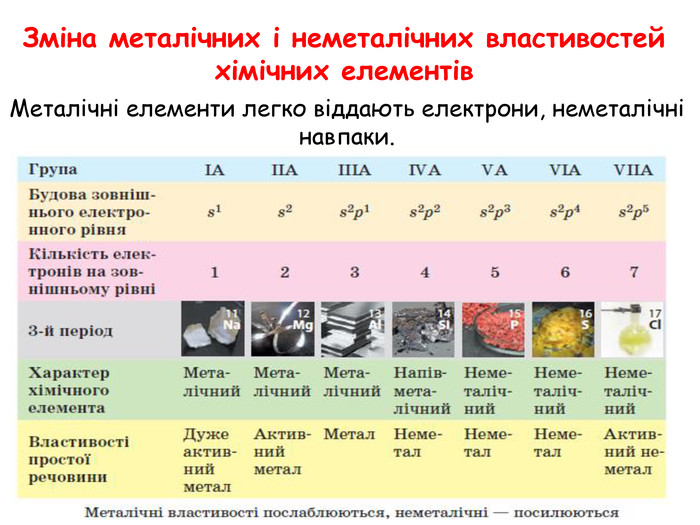



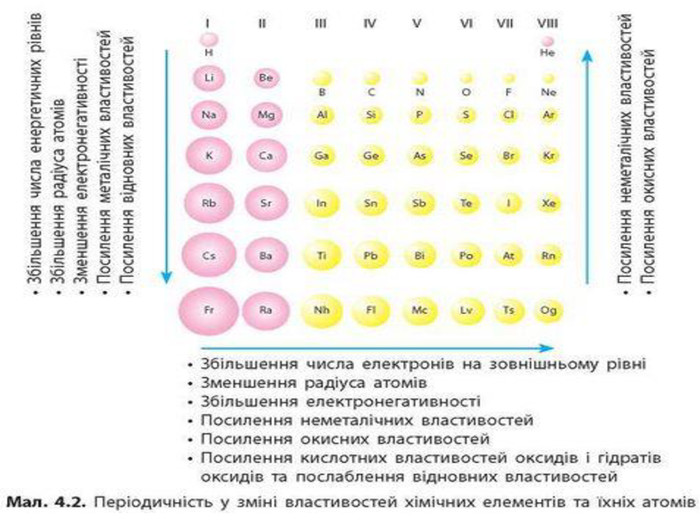
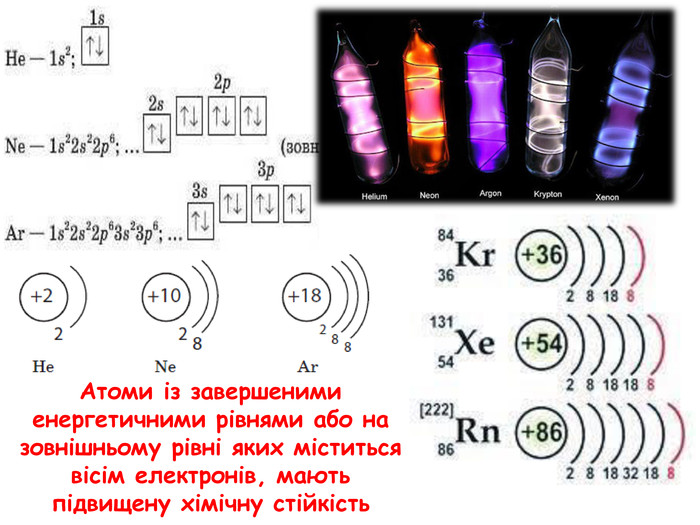






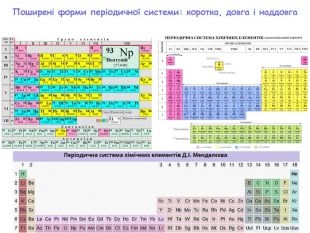

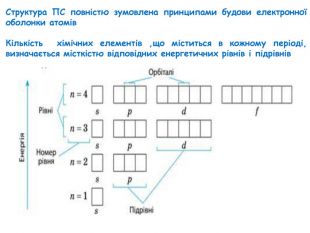
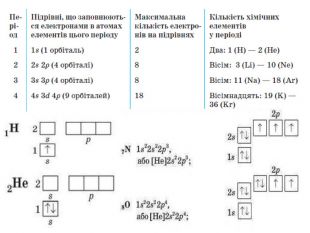
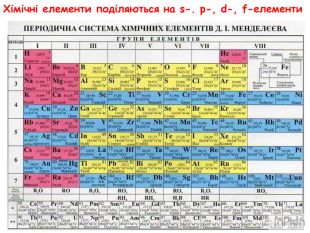
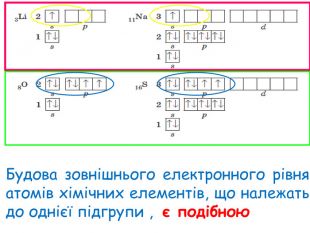
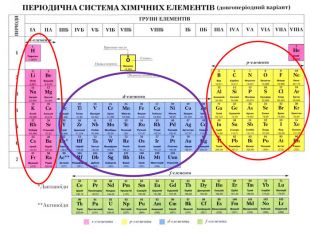
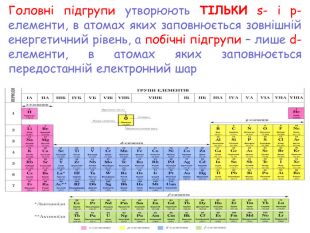



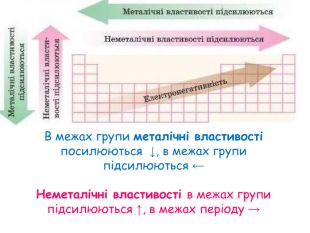

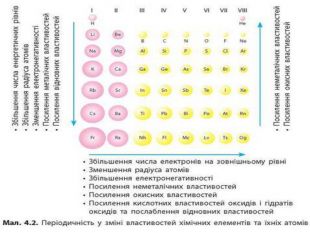
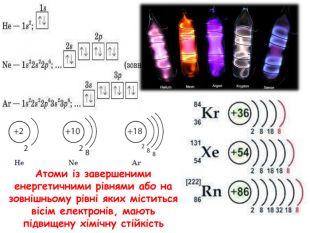
-

Потапова Галина Іванівна
01.10.2024 в 19:15
дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Котюк Тетяна Валеріївна
11.09.2024 в 23:31
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Кривобородько Віра Борисівна
09.11.2022 в 22:54
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Чепак Галина Олександрівна
29.09.2022 в 19:04
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Товстолес Лариса
20.09.2022 в 21:10
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Сивилла Трелони
04.11.2021 в 11:12
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 3 відгука