Плакат до уроку за темою "Амоніак. Склад молекули і будова речовини. Фізичні та хімічні властивості. Фізіологічна дія амоніаку"
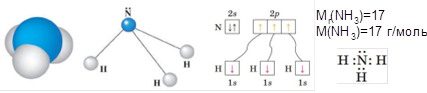
Амоніак. Склад молекули і будова речовини. Фізичні та хімічні властивості. Фізіологічна дія амоніаку
Фізичні властивості амоніаку
• за звичайних умов безбарвний газ із характерним різким запахом;
• дуже добре розчинний у воді: 1200 л в 1 л за 0°С та 700 л — за
20°С, розчин амоніаку у воді називають нашатирним спиртом;
• tкип.=–33°С, tпл.=–78°С;
• густина за нормальних умов 0,76 г/л;
• легко скраплюється, у рідкому стані — безбарвна рухома рідина.У побуті та промисловості частіше використовують назву «аміак»
 Для речовини з такою невеликою молярною масою амоніак має досить високу температуру кипіння (порівняйте: tкип.(CH4)=–162°С). Це пояснюється можливістю утворення водневих зв’ язків між його молекулами. Добра розчинність у воді - утворенням водневих зв’язків між молекулами амоніаку і води. За розчинністю у воді амоніак є рекордсменом серед інших газів.
Для речовини з такою невеликою молярною масою амоніак має досить високу температуру кипіння (порівняйте: tкип.(CH4)=–162°С). Це пояснюється можливістю утворення водневих зв’ язків між його молекулами. Добра розчинність у воді - утворенням водневих зв’язків між молекулами амоніаку і води. За розчинністю у воді амоніак є рекордсменом серед інших газів.
Біологічне значення амоніаку полягає в тому, що він є продуктом азотистого обміну в організмі людей і тварин. Утворюється під час метаболізму білків, амінокислот та інших нітрогеновмісних сполук. Амоніак дуже токсичний для організму. Тому більша частина його перетворюється печінкою в менш шкідливу речовину — карбамід
(сечовину), яка частково виводиться нирками
Фізіологічна дія амоніаку
Амоніак належить до групи речовин задушливої дії. Його пари дуже подразнюють слизові оболонки очей та органів дихання, а також шкіру. Крім того, зріджений амоніак під час випаровування поглинає теплоту, тому при зіткненні зі шкірою може спричинити обморожування. Отже, якщо відчувається запах амоніаку, то працювати без засобів захисту небезпечно. Засоби першої допомоги в разі отруєння амоніаком:
•свіже повітря,
•промивання очей великою кількістю води,
•вдихання водяної пари.
Добування амоніаку
У лабораторії амоніак одержують дією лугів на солі амонію при нагріванні.
Хімічні властивості амоніаку
|
Відео 1 |
|
Відео 2 |
![]()
![]()

![]()
![]() Кислотно-оснóвні властивості амоніаку зумовлені можливістю його молекул утворювати четвертий зв’язок за донорно-акцепторним механізмом. У водному розчині молекули амоніаку утворюють із молекулами води гідрат NH3·H2O, який піддається електролітичній дисоціації:
Кислотно-оснóвні властивості амоніаку зумовлені можливістю його молекул утворювати четвертий зв’язок за донорно-акцепторним механізмом. У водному розчині молекули амоніаку утворюють із молекулами води гідрат NH3·H2O, який піддається електролітичній дисоціації:
У цьому процесі на йони амонію перетворюються близько 2 % молекул амоніаку (у розчині з масовою часткою ≈0,2 %), отже, амоніак є слабкою основою.
Іноді за аналогією з лугами водний розчин амоніаку називають амоній гідроксидом і записують його формулу у вигляді NH4OH. Але такої сполуки не існує ані в розчині, ані в індивідуальному вигляді. Водний розчин амоніаку містить переважно молекули амоніаку, які дисоціювали лише незначною мірою. Однак усі молекули амоніаку утворюють водневі зв’язки з молекулами води, тому розчин амоніаку правильно записувати як гідрат амоніаку: NH3·H2O. Оснóвні властивості амоніаку виявляються в реакціях із кислотами.
Солі, утворені амоніаком і слабкими кислотами, піддаються гідролізу.
!!! Амоніак взаємодіє із сильними кислотами, кислотами середньої сили та не дуже слабкими (метанова, етанова, сульфітна тощо). Зі слабкими багатоосновними кислотами (карбонатна, ортофосфатна, сульфідна) він утворює лише кислі солі.
Горіння амоніаку. Амоніак є відновником. Він горить у чистому кисні або у збагаченому киснем повітрі блідо-жовтим полум’ям з утворенням азоту і води:

![]()
![]() За наявності каталізатора (платини або хром(III) оксиду) амоніак окиснюється з утворенням нітроген(II) оксиду, який використовують для виробництва нітратної кислоти:
За наявності каталізатора (платини або хром(III) оксиду) амоніак окиснюється з утворенням нітроген(II) оксиду, який використовують для виробництва нітратної кислоти:
Окиснення амоніаку з каталізатором — промислово важлива стадія процесу фіксації атмосферного азоту і нітрифікації ґрунтів.
При нагріванні амоніаку з оксидами важких металічних елементів і галогенами він відновлюється до вільного азоту:
Д/з §33, тест (до 03/12)


про публікацію авторської розробки
Додати розробку
