План-конспект уроку Будова води. Вода як розчинник
Дата уроку: 14 вересня 2023
Тема урока: Будова води. Вода як розчинник. Водневий зв’язок.
Клас: дев’ятий
Мета:
- Навчальна – поглибити знання учнів про будову води, ознайомити з новим видом зв’язку – водневим, та визначити як вода розчиняє речовини;
- Розвиваюча – розвити у дітей навички логічного мислення, навички аналізу отриманої інформації (робити висновки та виділяти найважливіші моменти).
- Виховна – виховувати у дітей взаємоповагу одне до одного та повагу до вчителя; розвити навички концентрації на матеріалі;
Тип уроку:
Форми і методи навчання: пояснювально-ілюстративні: розповідь, взаємодія із класом (бесіда), робота з опорною схемою; практичні: робота біля дошки, виконання вправ.
Обладнання: презентація, періодична система хімічних елементів Д.І. Менделєєва, ряд електронегативностей, опорні таблиці та схеми,
Література:
для учнів:
для вчителя:
- Григор’єва В.В., Самійленко В.М., Сич А.М. Загальна хімія. – К.: Освіта 1991. – 380 с.
- Григорович О.В. Хімія: підручник для 9 класу загальноосвіт. навч. закладів. — Харків.: Вид-во «Ранок», 2017. — 256 с.: іл.
Структура уроку
II. Актуалізація опорних знань
III. Вивчення нового матеріалу
1. Вода. Повторення фізичних та хімічних властивостей
3. Утворення водневого зв’язку
4. Чому і як вода розчиняє речовини?
I. Організаційний етап
- Привітання (Доброго дня, я студента 4 курсу хімічного факультету університету імені Каразіна Єрьомкіна Світлана Сергіївна). Сьогодні я буду вашим вчителем, тож давайте не гаяти часу та розпочнемо з перевірки присутніх.
II. Актуалізація опорних знань
Перш ніж розпочинати нову тему, давайте перевіримо ваше домашнє завдання, яке було на сьогодні. Хто може його пригадати? (запитати або дочекатися відповіді).

Відповідь: до зависей, оскільки містить нерозчинні у воді (розчиннику) частинки
- Якщо розчини тільки мідний купорос у воді, який це буде дисперсний розчин? (істиний)
- Як можно відризнити істинний розчин від колоїдного окрім на зовнішній вигляд? (колоїдні розчини розсіюють світло)
- Що потрібно додати до води, щоб отримати гель в домашніх умовах? (гелеутворювач – агар агар, желатин)
![]()

III. Вивчення нового матеріалу
Тепер перейдемо безпосередньо до теми нашого уроку. Відкриваємо зошити та записуємо число, сьогодні 14 вересня, четвертий урок. Тема уроку показана на слайді «Будова води. Вода як розчинник. Водневий зв’язок.». Давайте я ознайомлю з планом і метою нашої роботи.
1. Вода. Повторення фізичних та хімічних властивостей
Ви знайомі з водою з перших днів свого життя, тому деякі її властивості, якщо не всі, вам відомі. Тож бо, давайте пригадаємо все про воду, її властивості та характеристики.
- Чи має вода смак? А запах? (ні)
- Температура кипіння води складає…При якому тиску (100 градусів по Цельсію, 1 атм)
- А скільки потрібно температури для води, щоб вона замерзла? (0 градусів за Цельсієм)
- В яких агрегатних станах може перебувати вода? (твердий, рідкий, газ)
- Наведіть приклади до кожного стану
- Чи проводить вода електричний струм? (погано)
- Яка хімічна формула води? (Н2О)
- Які елементи входять до складу? (Оксиген та гідроген)
- Який хімічний зв’язок у води? (ковалентний полярний)
2. Будова води
Ось ми і підійшли до будови води. Як вже ми повторили вона має ковалентний полярний тип зв’язку, давайте це доведемо. Щоб довести це, нам потрібно подивитися на ряд електронегативностей – до речі, хто пам’ятає що таке електронегативність? (здатність атомів елемента в хімічних сполуках відтягувати до себе електрони, що беруть участь в утворенні хімічних зв’язків.) – в ковалентному полярному різниця електронегативностей повинна бути в діапазоні від 0,4 до 2. Давайте дивитись у оксигена 3,5, а у гідрогена 2,1 різниця буде дорівнювати чому? (1,4). Ця різниця лежить в нашому діапазоні? (так) Тому, цей зв’язок ковалентний полярний, ми це довели.
- Хто мені скаже за рахунок чого утворюється цей зв’язок? (спільні електронні пари).
У молекулі води є два ковалентні полярні зв’язки між атомом оксигену та двома атомами гідрогену – електронні хмари зміщені в бік оксигену, внаслідок чого молекула води є диполем, який можна умовно представити еліпсом.
Давайте запишемо, що «Диполь – це частинка, в якій на різних її кінцях існують полюси зарядів». (запис до зошита під диктовку).
До речі, не всі молекули будуть диполями, це залежить від просторової будови. Наприклад, СО2 має лінійну будову в просторі, його електронні хмари будуть на одному рівні, тобто нікуди не зміщені.
Через нерівноцінність станів електронних хмар валентний кут – можливо хтось знає, що це? (кут, утворений двома напрямками хімічних зв'язків, що виходять з одного атома.) становить 104,5 градусі. Твердий стан води – це…(лід).
Рис. 1. Графічна модель води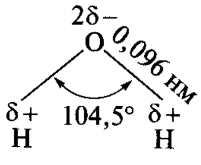
3. Утворення водневого зв’язку
Давайте поглянемо на малюнок утворення ковалентного зв’язку між атомами оксигену та гідрогену. Ми вже довели, що у молекули води ковалентний полярний тип зв’язку. Хто може назвати головний принцип доведення, що зв’язок ковалентний полярний? (різниця електронегативностей в діапазоні 0,4 – 2).
Рис. 2 Утворення ковалентного зв’язку води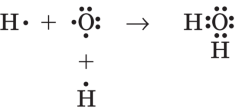
Кожний з вільних електронів оксигену з’єднується з вільним електроном гідрогену. До речі ви пам’ятаєте, що таке електрон? (негативно заряджена елементарна частинка). Тоді скільки неподілених електронних пар лишається у оксигена? (дві)
Ці електронні пари утворюють підвищену електронну густину навколо атома Оксигену й дозволяють йому взаємодіяти з іншими частинками (йонами або молекулами), у яких «дефіцит» електронної густини. Отже, між атомом Оксигену однієї молекули води та атомом Гідрогену іншої молекули виникає додаткова взаємодія:
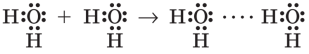 Рис. 3. Утворення водневого зв’язку
Рис. 3. Утворення водневого зв’язку
Спільні електронні пари разом з електронами, які не брали участі в утворенні хімічних зв'язків, концентрують на атомі Оксигену частково негативний заряд δ- (читається «дельта мінус»). Відповідно на атомах Гідрогену зосереджений частково позитивний заряд δ+ (читається «дельта плюс»).
 Рис. 4. Водневий зв’язок через дельти
Рис. 4. Водневий зв’язок через дельти
Механізм утворення одного такого зв'язку полягає в притяганні дельти мінус оксигену до дельти плюс гідрогену. Такий вид хімічного зв'язку називають водневим.
Цей зв’язок також називають міжмолекулярним, бо він виникає між атомами Гідрогену однієї молекули (диполя) з поляризованим атомом (що має велику електронегативність – який елемент таблиці Мендєлєєва має найбільшу електронегативність? (флуор): F, N, O) другої молекули внаслідок набуття ними протилежних часткових електричних зарядів.
Давайте запишемо у зошит визначення «Водневий зв’язок — це взаємодія атома Гідрогену, який утворив з електронегативним атомом (Оксигену, Нітрогену або Флуору) одну молекулу зі значно електронегативним атомом іншої молекули.». (запис до зошиту під диктовку)
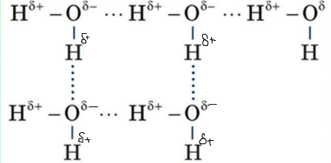 Рис.5. Міжмолекулярна взаємодія
Рис.5. Міжмолекулярна взаємодія
Водневий зв’язок частіше за все показують крапками. На слайді ви бачите приклади з перерахованими атомами.
Сила водневого зв'язку невелика, і порівняно з ковалентним він набагато слабший. Але його енергії вистачає, щоб утримувати молекули води разом на певній відстані – так вода і стає рідкою. В газоподібному стані між молекулами зв’язку водневого вже немає, а в твердому молекули води в льоду утворюють водневий зв’язок, де оксиген має два водневих зв’язка.
Водневий зв'язок впливає на фізичні властивості речовин – підвищуються температури плавлення й кипіння, зменшується густина. Це пов’язано з тим, що потрібна додаткова енергія для розриву водневого зв’язку.
4. Чому і як вода розчиняє речовини?
Давайте пригадаємо з минулого уроку що таке розчинник? (Речовина, що міститься в розчині в надлишку й перебуває в тому самому агрегатному стані, що й розчин або індивідуальна хімічна сполука або суміш, здатна розчиняти різні речовини, тобто утворювати з ними однорідні системи змінного складу, що складаються з двох або більшого числа компонентів — розчини.) Вода є одним з найважливіших та найуніверсальніших розчинників в природі. Її властивості роблять її ідеальним розчинником для багатьох речовин.
Що ж робить її універсальним розчинником?
1. Полярність: ми вже визначили, що молекула води є диполем. Завдяки такому розподіленню електричних зарядів молекула води є полярною. Ця полярність дозволяє воді взаємодіяти з іншими полярними молекулами і іонами шляхом електростатичних сил, що сприяє їх розчиненню.
2. Водневі зв'язки, що виникають між молекулами води, забезпечують структуру і стабільність рідини. Ці зв'язки допомагають розчиняти речовини, де також присутні полярні молекули чи іони.
3. Властивість розчинення газів: які гази добре розчиняє вода? (кисень, діоксид вуглецю та амоніак, сірководень, водень). Саме тому у вас є можливість пити газовані напої, а у риб дихати під водою.
4. Властивість утворення розчинів різних концентрацій: що таке розчини? (це однорідні суміші змінного складу, що складаються з двох або більше компонентів, один з яких зазвичай є рідкий). Вода дозволяє зробити будь-який розчин. Згадаємо як розчиняється цукор або сіль у воді. Чим більше цукру, тим солодша вода і тим концентрація цукру збільшується.
Давайте розглянемо як вода розчиняє в собі речовини. Наприклад кухонна сіль, хто може назвати її хімічну формулу? (NaCl), яка в неї кристалічна гратка? (іонна). Давайте ще раз згадаємо, що таке диполь? (диполь – це частинка, в якій на різних її кінцях існують полюси зарядів).
У разі потрапляння кристала солі у воду молекули води орієнтуються навколо заряджених йонів: до + заряджених йонів молекули притягуються – йони хлору, бо він має заряд -, а до - йонів — +, натрій в даному випадку.
Молекули води починають притягувати йони до себе. Коли сила притягання йонів до молекул води стає більшою за силу, що утримує йони між собою, йон в оточенні молекул води переходить у розчин.
 Рис. 6. Розчинення солі
Рис. 6. Розчинення солі
Давайте запишемо, що «Гідратна оболонка - це молекули води, що оточує йони в розчині. Гідрати – це йони, оточені молекулами води.» (запис до зошиту під диктовку)
 Рис. 7. Гідрати
Рис. 7. Гідрати
Подібним чином розчиняються у воді й молекулярні речовини.
IV. Закріплення знань
Що ж, це весь матеріал, який я хотіла вам розповісти сьогодні. Ви попрацювали добре, але закріпити знання потрібно. Пропоную вам бліц-тест, щоб ще раз добренько все повторити. Відповідайте та думайте швидко, тема доволі легка.
- Валентний кут води? (104,5 градусів)
- Перерахуйте всі властивості води.
- Що таке дельта плюс та дельта мінус? (частково позитивний та негативний заряди)
- Що таке диполь? (диполь – це частинка, в якій на різних її кінцях існують полюси зарядів)
- З якими атомами гідроген може утворювати водневий зв’язок окрім оксигену? (нітроген та флуор)
- За допомогою чого – рисок, крапок чи хвилястих ліній – показують водневий зв’язок? (крапки)
- Водневий зв’язок сильніше полярного? (ні)
- Назвіть хоча б дві причини, чому вода універсальний розчинник? (водневі зв’язки, полярність, розчинення газів та концентрація)
- Що таке гідратна оболонка, а що таке гідрат? (гідратна оболонка - це молекули води, що оточує йони в розчині. Гідрати – це йони, оточені молекулами води.)
V. Домашнє завдання
Запишіть також домашнє завдання у щоденники, або у зошит:
Григорович О. В. Хімія. 9 клас – ваш підручник
- Читати: Читати: §4 – 5 (окрім кристалогідратів),
стр. 26 – 33, контрольні питання
- Задача: Розрахуйте масову частку нітратної кислоти в розчині, 0,7 л якого містить 270 г нітратної кислоти; густина розчину 1,12 г/мл.
VI. Підсумки уроку
Дякую учні за таку плідну роботу, мені було приємно попрацювати з вами та провести для вас цей урок.
Всі плани, які були поставлені на цьому уроці ми виконали, тепер ви знаєте набагато більше, а щось ми навіть повторили.
Хочу також поставити оцінки найбільш активним дітям.
Дякую за увагу!
1


про публікацію авторської розробки
Додати розробку
