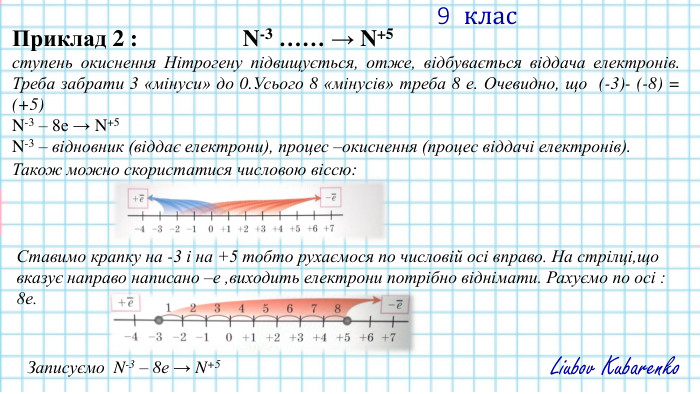
Окисно-відновні реакції. Процеси окиснення відновлення, окисники, відновники.
Про матеріал
Презентація до уроку на тему: "Окисно-відновні реакції, процеси окиснення і відновлення, окисники і відновники". Мета:розглянути класифікацію реакцій за зміною ступенів окиснення; познайомитися з окисно-відновними реакціями, процесами окиснення і відновлення; навчитися прогнозувати окисно-відновні властивості речовин. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Виправте помилки! Бо є різниця між МАГНІЄМ та МАНГАНОМ!!!

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку