План уроку "Агрегатний стан речовини"
ПЛАН УРОКУ
Епіграф до уроку: «Пізнати сутність неможливо ззовні, можливо тільки зсередини»
Філософ Н. Бердяєв
«Фізика – це наука розуміти природу»
Е. Роджерс
Тема уроку: Агрегатний стан речовини
Цілі уроку: розглянути особливості молекулярної будови та властивості тіл у різних агрегатних станах. Узагальнення, систематизація, поглиблення знань.
Завдання уроку: сприяти формуванню знань у учнів про фазові переходи, уміння пояснювати властивості речовини в різних агрегатних станах, на основі молекулярної будови речовини; розвивати уявлення про матеріальність світу, сприяти розвитку мови, мислення; виховувати позитивне ставлення до предмета.
Формування ключових компетентностей:
- основні компетентності у природничих науках і технологіях;
- інформаційно-цифрова компетентність;
- математична компетентність;
- уміння вчитися впродовж життя.
Обладнання: підручник «Фізика» ; пластикова пляшка, наповнена водою; пластикова пляшка, наповнена повітрям; дерев’яний брусок, дротина, повітряна кулька, вода, 4 різних за формою склянки, в 100-грамову склянку налита вода, шматок льоду, спиртівка.
Методи та прийоми: Рефлексія, мовний: бесіда, робота з підручником; наочний: демонстрація малюнків і таблиць; репродуктивний: розв’язування завдань; проблемно-пошуковий: проблемні питання.
Міжпредметні зв’язки: математика, природознавство, хімія.
Базові поняття й терміни: тіло, речовина, кристалічні та аморфні тіла агрегатні стани речовини, кристал.
I. Мотивація пізнавальної діяльності.
Як відомо, фізика – це наука про природу. Ми – частинка цієї природи, та чим краще ми будемо розрізняти фізичні поняття, тим краще будемо розуміти природу, тим раціональніше будемо використовувати її дарунки, тим впевненіше будемо відчувати себе на Землі. Сьогодні ми познайомимось з новими фізичними поняттями, явищами, дослідами. Тому вмикаємо увагу, налаштовуємось на роботу та на отримання нових знань.
А для початку я запропоную три загадки, подивимось, чи справитесь ви з ними.
1. Біла морква зимою росте (бурулька)
2.Мене частенько просять, ждуть,
А тільки покажусь – ховатися почнуть (дощ).
3.Коли чайник закипає, я із нього утікаю. (водяна пара).
Що спільного між словами відгадками? (різний агрегатний стан однієї речовини води).
Учні самостійно формують тему уроку. Агрегатні стани речовини.
То ж давайте сьогодні поговоримо про тверді речовини, рідини і гази, і з’ясуємо, за якими ознаками вони відрізняються між собою.
IІ. Актуалізація знань
1. Моделлю матеріального тіла є сукупність атомів (молекул), що рухаються і взаємодіють між собою.
2. Яка фізична величина є основною характеристикою хімічного елемента? Заряд ядер атома.
Уважно поспостерігаємо три прості досліди, усно заповнимо таблицю на дошці. Ця таблиця допоможе уточнити тему сьогоднішнього уроку.
|
Спостережуваний дослід |
Що я побачив |
Речовини, що беруть участь у досліді |
Висновки |
|
Опускаємо у воду перевернуту вгору дном склянку. |
|
|
|
|
Переллємо воду з однієї судини до іншої. |
|
|
|
|
Згинаємо сталеву лінійку. |
|
|
|
Давайте подумаємо разом, що сьогодні на уроці ми маємо з'ясовувати?
Після обговорення відповідей учнів вчитель узагальнює:
Речовини можуть бути у трьох агрегатних станах: рідкому, твердому та газоподібному.
Мета нашого уроку полягає в тому, щоб з'ясувати:
▪ Чи всі речовини можуть бути у твердому, рідкому та газоподібному стані?
▪ Чи змінюються молекули речовини при переході з одного стану в
інше?
▪ Чому властивості речовин у різних агрегатних станах різняться
один від одного?
Отже, щоб отримати необхідні знання, дивимося на презентацію «Агрегатні стани речовини. Будова твердих, рідких та газоподібних тіл»
Чим відрізняється будова твердих тіл, рідин та газів?
Запитання вчителя. Що таке лід? Це замерзла вода.
Запитання вчителя. А що таке пара? Випарована вода
Запитання вчителя. Лід, пара та вода це різні речовини чи ні?
Чи можна змінити агрегатний стан речовини?
Деякі речовини відомі нам у природних умовах тільки в одному стані, наприклад, ртуть – рідина, повітря – газ, залізо – тверде тіло. Але і ці речовини можуть перебувати в усіх трьох станах.
Сильним охолодженням дістають рідке і навіть тверде повітря.
Залізо при досить високих температурах можна не тільки розплавити, а й перетворити в газ.
Ртуть переходить у твердий стан при -39°С. Іноді з засобів масової інформації ми чуємо, що люди отруїлися парами ртуті (учні висловлюють свої міркування, інформація з ТБ і охорони праці).
Але найкращим представником, який демонструє нам три агрегатні стани є вода: лід – твердий стан, сама вода - рідкий стан, і водяна пара – газоподібний стан.
Порівняємо основні властивості речовини в різних агрегатних станах.(Під час обговорення учні заповнюють таблицю про властивості речовини)
Чи можна змінити форму твердого тіла, рідини, газу?
Демонстрація переливання рідини.
-В яких агрегатних станах речовина зберігає свою форму?
Тільки у твердому стані. Рідина приймає форму посудини. Гази займають весь наданий їм простір.
-В яких агрегатних станах речовина зберігає свій об'єм?
Демонстрація (спроби стиснути металевий важок, заповнену водою закриту пластикову пляшку, не дуже сильно надуту повітряну кульку).
Отже, речовина зберігає об'єм у твердому та рідкому станах. Газ займає весь наданий об’єм. Його можна і стиснути відносно легко. А от помітного стискання рідин і твердих тіл не спостерігається.
Чому ж так відрізняються властивості речовини в різних станах? Адже і рідка вода, і лід, і водяна пара складаються з одних і тих самих молекул. Відмінності обумовлені характером розташування, руху та взаємодії молекул.(Результати порівняння оформляються як таблиця)
Чи завжди вода буває тільки рідкою? Відгадайте загадку
Я і хмара, і туман, і струмок, і океан.
Я літаю і біжу, іноді, як скло лежу.
Чому про воду говорять по-різному: біжить, літає, лежить, як скло?
Отже, вода буває в трьох станах (демонстрація води, льоду, як кипить чайник)
Наведіть ще приклади води: в рідкому стані (дощ, роса, туман, хмара), в твердому стані (бурулька, сніг, крига, айсберг, іній, град, візерунки на склі), в газоподібному стані (водяна пара, веселка)
|
Рідкий стан |
Твердий стан |
Газоподібний стан |
|
Дощ, туман, роса, хмари |
Лід, іній, бурульки, град, візерунки на склі, сніг, крига, айсберг |
Водяна пара, веселка |
Виберіть зі списку речовини, що перебувають у твердому стані у рідкому стані в газоподібному стані та запишіть їх у таблицю
Залізо, кисень, лід, бензин, вуглекислий газ, дерево, вода, пластмаса, водяна пара, спирт, скло, нафта.
|
Тверді тіла |
Рідини |
Гази |
|
|
|
|
IІІ. Пояснення нового матеріалу
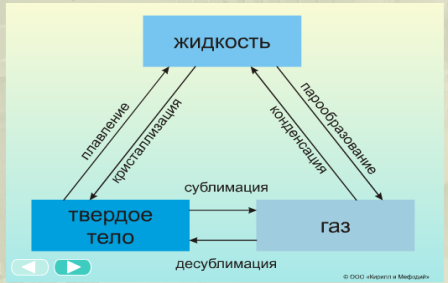
Речовина може перебувати в трьох станах: твердому, рідинному чи газоподібному. Ці стани речовини називають агрегатними станами.
На малюнку зображене розташування молекул газу (а), рідини (б), твердого тіла (в).
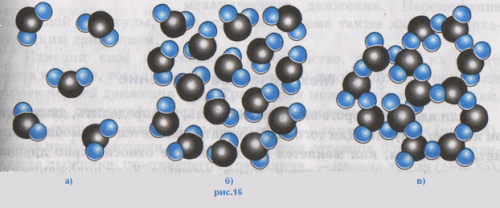
Найпоширеніша речовина, яка широко зустрічається у всіх трьох станах це вода.

Перехід із одного стану до іншого.
Проблемне питання.
Чи змінюються властивості речовини у різних агрегатних станах?
Відпрацювати поняття об’єму та форми тіла. Демонстрація поролону Демонстрація різних твердих тіл. З'ясування властивостей твердих тіл.
Висновок. Тверді тіла зберігають форму та обсяг.

1. Гази
«Бродяги» взад-вперед снуют,
Без отдыха везде бегут»

Газоподібні та рідкі речовини не мають постійної форми, а тому завжди набувають форми посудини, в якій їх тримають
Газ (французька gaz, що сталося від грецького хаос — хаос) — це агрегатний стан речовини, в якому сили взаємодії його частинок, що заповнюють весь наданий їм об'єм, пренебрежимо малі.
У газах відстані між молекулами значно більші, ніж розміри молекул - приблизно в 10 разів більша за розміри молекул.
Наприклад, при атмосферному тиску об’єм посудини в десятки тисяч разів перевищує об’єм молекул газу в ньому.
Молекули хаотично рухаються, відносно рідко зазнають зіткнень одна з одною. Отже, вони слабо взаємодіють одна з одною.
Молекули рухаються в просторі з величезними швидкостями — сотні метрів за
секунду. Гази легко стискаються, при цьому зменшується середня відстань між
молекулами. Стикаючись, вони відскакують одна від одної подібно до
більярдних куль.
Слабкі сили притягання молекул газу не можуть утримати їх одну біля одної.
Гази здатні необмежено розширюватися. Вони не зберігають ні форми, ні об’єму. Численні удари молекул об стінки посудини створюють тиск газу.
Рух молекул газу певною мірою нагадує рух комах в закритій посудині.
Не можна наповнити газом, наприклад, половину пляшки або склянки, тому що, рухаючись в усіх напрямах і майже не притягуючись одна до одної, молекули газу швидко заповнюють усю посудину.
Багато газів прозорі і безбарвні, тому ми їх не бачимо. Ми не бачимо, наприклад, повітря. Але при швидкому русі, перебуваючи в автомобілі, поїзді, а також коли дме вітер, ми помічаємо присутність повітря навколо нас.
Проблемне завдання.
Чи порожня склянка? Демонстрація досліду зі склянкою.
Висновок. Склянка не порожня, вона заповнена газом.
Чи можуть гази зберігати свій об’єм незмінним? Дослід із повітряною кулею. Гумовою рукавичкою.
Висновок. Гази займають весь наданий об’єм, не зберігаючи ні початковий об’єм, ні форму.


Отже, перехід рідини у газоподібний стан відбувається внаслідок розриву зв'язків між її молекулами. Вони починають вільно рухатися в усьому наданому їм просторі, взаємодіючи лише під час короткочасних зіткнень. Їх можна порівняти із співударом кульок, які розлітаються тим дужче, чим з більшою швидкістю наближаються одна до одної.
Якщо температура газу знижується, то швидкість хаотичного руху молекул зменшується. За цих умов може статися, що окремі молекули, наближаючись одна до одної, починають взаємодіяти і «злипаються» в маленькі крапельки. Відбувається конденсація — зворотний до випаровування процес, тобто перехід речовини із газоподібного в рідкий стан. Іноді цей процес називають скрапленням газу.
Запис у зошит.
Властивості газів:
Властивості газів визначаються в основному рухом молекул, оскільки взаємодією молекул можна знехтувати. У зв'язку з тим, що молекули в усіх газах рухаються практично однаково, властивості різних газів подібні.
- Не зберігають ні форми, ні об’єму, легко стискуються.
- Характер молекулярного руху – безладний, хаотичний рух.
- У газах відстань між атомами або молекулами значно більші за розміри самих
молекул. Гази не мають власної форми і об’єму.
2. Рідини
«Кочевники» то там, то тут,
На месте долго не живут.


В інших речовинах, навпаки, молекули зв'язані слабко і відстані між ними більші. Це дає їм змогу вільно переміщуватися одна відносно одної. Такі речовини мають рідкий агрегатний стан.
Молекули рідини розташовані досить щільно, відстані між ними невеликі. Характер руху такий: майже весь час молекули коливаються (немовби дрижать), і лише інколи протискуються між найближчими сусідами та трохи змінюють своє місце. Певного порядку в розташуванні немає. Це дуже нагадує розташування та рух людей у густому натовпі під час якихось видовищ.
Рідина - це агрегатний стан речовини, проміжне між твердим і газоподібним. Рідин притаманні деякі риси твердої речовини (зберігає свій об’єм, утворює поверхню, володіє певною міцністю на розрив) і газу (приймає форму судини, в якій знаходиться).
В рідини середня енергія взаємодії молекул приблизно дорівнює середньої енергії теплового руху. Тепловий рух порушує зв'язок між молекулами і призводить до переміщення їх відносно один одного всередині об'єму рідини. У зв'язку з цим рідина приймає форму посудини, в який вона поміщена.
Затиснута, як у клітці, іншими молекулами, вона виконує «біг на мiсцi» (коливається біля положення рівноваги стикаючись із сусiднiми молекулами)
Лише час від часу молекула робить «стрибок», прориваючись крізь «прути клітки», але тут же потрапляє в нову «клітку» утворену новими сусідами. Час «осілого життя» молекули води, тобто час коливань біля одного певного положення рівноваги, при кiмнатнiй температурі дорівнює в середньому 10-11с. А час, за який відбувається одне коливання, значно менший (10-12 10-13 с). 3 підвищенням температури час осілого життя молекул зменшується. Характер молекулярного руху в рідинах, вперше встановлений радянським фізиком Я. І. Френкелем, дає змогу зрозуміти основні властивості рідин.
Властивості рідин пояснюються тим, що проміжки між їхніми молекулами малі: молекули в рідинах розташовані так щільно, що відстань між кожними двома молекулами менша від розмірів самої молекули. На таких відстанях взаємне притягання молекул уже значне. Тому молекули рідини не розходяться на великі відстані й рідина за звичайних умов зберігає свій об’єм. Проте притягання молекул рідин ще не таке велике, щоб рідина зберігала свою форму. Цим пояснюється, що рідини набирають форми посудини і їх легко роз бризкати та перелити в іншу посудину.
Молекули рідини розмiщеннi безпосередньо одна біля одної. Тому при спробі змінити об’єм рідини навіть на малу величину починається деформація самих молекул. А для цього потрiбнi дуже великі сили. Цим пояснюється мала стисливість рідин.
Рідини, як відомо, текучі, тобто не зберігають своєї форми. Пояснити це можна так. Якщо рідина не тече, то перескоки молекул з одного осілого положення в інше відбуваються з однаковою частотою у всіх напрямах. Зовнішня сила помітно не змінює кiлькостi перескоків молекул за секунду, але перескоки молекул з одного «осілого» положення в інше відбуваються при цьому переважно в напрямі дії зовнішньої
Стискаючи рідину, ми так зближуємо її молекули, що вони починають відштовхуватись. Ось чому рідину важко стиснути.
Наведіть приклади відомих вам рідин.
Демонстрація (три судини різної форми) беруться три судини різної форми, що мають шкалу для визначення об’єму . У перший раз наливається 150 мл підфарбованої води. Потім вона переливається до інших судин і з'ясовується, що об’єм рідини не змінився.
Висновок. Рідини не мають власної форми, вони набувають форми судини, де знаходяться, зберігаючи об’єм.
У рідині середня енергія взаємодії молекул приблизно дорівнює середньої енергії теплового руху. Тепловий рух порушує зв'язок між молекулами та призводить до переміщення їх відносно один одного всередині об'єму рідини. У зв'язку з цим рідина набуває форми судини, в яку вона поміщена.
Якщо рідину охолоджувати, молекули поступово втрачають рухливість, оскільки зв'язки між ними посилюються. Вони починають займати певні положення, продовжуючи коливатися відносно них. За певної температури відбувається кристалізація, або тверднення, — процес, зворотний до плавлення.
Що ж відбувається з рідиною зі зміною її температури?
Як відомо, молекули рідини взаємодіють таким чином, що утримуються одна біля одної, але не втрачають при цьому своєї рухливості. Вони коливаються і час від часу стрибкоподібно переміщуються, ніби просочуючись поміж сусідніми молекулами. Тому рідинам властива текучість і вони набувають форми посудини, в якій містяться.
Рідини випаровуються з вільної поверхні, яку вони утворюють на межі з газом. Це відбувається тоді, коли окремі молекули втрачають зв'язок з найближчими сусідами і починають вільно рухатися над поверхнею рідини.
Очевидно, що чим вища температура, тим більше молекул виривається з вільної поверхні рідини. Це підтверджує і наш життєвий досвід. Адже відомо, що в теплу погоду білизна висихає швидше, ніж у холодну
Висновок: не можна відрізнити воду, добуту з соку чи молока від води добутої перегонкою морської води, бо молекули води однакові в будь-якому стані й ніяка інша речовина не складається з таких самих молекул.
Запис у зошит.
Властивості рідин:
- Зберігають об’єм, але не зберігають форми.
- Основна властивість – плинність.
- Характер молекулярного руху – коливання атомів та молекул відносно положення рівноваги та їх перескакування в інші позиції.
- Молекули в рідинах щільно упаковані, відстань між молекулами менша за саму молекулу.
3. Тверді тіла
«Оседлые».
Их можно так назвать.
Не могут место поменять.


Ми вже знаємо, що молекули безперервно рухаються. Однак в одних речовинах вони настільки близько розташовані одна до одної та міцно зв'язані між собою, що можуть лише коливатися. Про такі речовини говорять, що вони тверді, тобто мають твердий агрегатний стан.
У твердих тілах молекули нагадують парадну військову шеренгу (таке розташування називають кристалічною решіткою).Рух молекул зводиться до коливань поблизу «свого місця в шерензі».
Речовина знаходиться в твердому стані, якщо середня потенціальна енергія тяжіння молекул багато більше їх середньої кінетичної енергії.
Частинки (молекули або атоми) більшості твердих тіл, таких
як лід, сіль, нафталін, метали, розміщені в певному порядку. Хоч частинки цих тіл і перебувають у русі, але кожна з них рухається навколо певної точки подібно до маятників годинників. Частинка не може переміститися далеко від цієї точки, тому тверде тіло зберігає свою форму
Тверді тіла в звичайних умовах зберігають і об’єм, і форму. Це пояснюється тим, що тяжіння між їх частками ще більше, ніж у рідин.
Деякі з твердих тіл, наприклад сніжинки, мають природну правильну і красиву форму. Частинки (молекули або атоми) більшості твердих тіл, таких, як лід, сіль, нафталін, метали, розташовані в певному порядку. Такі тверді тіла називають кристалічними.
Тверді тіла поділяються на кристалічні та аморфні.

Кристалічний стан речовини – це агрегатний стан, який характеризується великими силами взаємодії між частинками речовини (атомами, молекулами, іонами).
Частинки твердих тіл здійснюють коливання у середніх рівноважних положень, званих вузлами кристалічних ґрат.


Структура цих речовин характеризується високим ступенем упорядкованості (далеким та ближнім порядком) — упорядкованістю в розташуванні (координаційний порядок), в орієнтації (орієнтаційний порядок) структурних частинок, або впорядкованістю фізичних властивостей (наприклад, в орієнтації магнітних моментів або електричних дипольних моментів).

Очевидно, що в твердому стані речовина перебуває тоді, коли атоми і молекули взаємодіють настільки сильно, що знаходяться у чітко фіксованих положеннях. Вони практично не переміщуються, а лише хаотично коливаються відносно своїх стабільних положень. Треба докласти певних зусиль, щоб тіло змінило надану йому форму. Наприклад, можна розплющити залізний цвях ударами молотка; виліпити фігуру з пластиліну. Проте якщо ми спробуємо зігнути скло, воно розкришиться. Разом з тим відомо, що майстри-склодуви виробляють чудові художні вироби, попередньо нагрівши скло до певної температури. Ковалі розжарюють у горнах металеві заготівки, щоб вони були податливіші під час кування. Тобто властивості твердого тіла залежать також від його температури.
Якщо підвищувати температуру, то настане момент, коли тверде тіло почне плавитися і перетвориться на рідину. Підвищення температури твердого тіла веде до послаблення зв'язків між атомами і молекулами. Тобто атоми і молекули твердого тіла внаслідок нагрівання набувають такої рухливості, що вже можуть, як у рідинах, стрибкоподібно пересуватися. У кристалічних тілах (наприклад, металах) це відбувається за певної температури, яку називають температурою плавлення. Так, температура плавлення алюмінію дорівнює 660 °С, заліза — 1535 °С, вольфраму — 3387 °С.
Атоми або молекули твердих тіл на відмінну від рідин коливаються біля певних положень рівноваги. Правда, іноді молекули змінюють положення рівноваги, але трапляється це рідко. Ось чому тверді тіла зберігають не тільки об’єм, а й форму.
Є ще одна важлива відмінність між рідинами i твердими тілами. Рідину можна порівняти з натовпом, окремі члени якого метушливо штовхаються на місці , а тверде тіло подібне до стрункої когорти, члени якої хоч i не стоять «струнко» (внаслідок теплового руху), але витримують між собою в середньому певні інтервали. Якщо сполучити центри положень рівноваги атомів, або іонів твердого тіла, то матимемо правильну просторову решітку, яка називається к р и с т а л i ч н о ю. Внутрішній порядок у розміщенні атомів кристалів зумовлює геометрично правильну зовнішню форму. Знаючи розташування однієї частинки в кристалі, можна точно розрахувати, де перебуває не тільки сусідня, а й найдальша частинка. У розташуванні частинок кристала існує дальній порядок.
Якщо рідину охолоджувати, молекули поступово втрачають рухливість, оскільки зв'язки між ними посилюються. Вони починають займати певні положення, продовжуючи коливатися відносно них. За певної температури відбувається кристалізація, або тверднення, — процес, зворотний до плавлення.
Прикладами кристалів є кухонна сіль і цукор.
Кристали мають правильну форму, це зумовлено тим, що атоми або молекули в кристалах розташовані упорядковано, утворюючи кристалічні ґратки.
Наприклад, у кристалі кухонної солі атоми Натріюта Хлору строго чергуються, розташовуючись у вершинах куба, — тому кристали солі й мають форму куба.
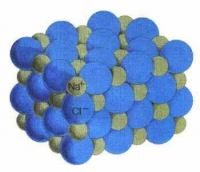
А в кристалі льоду молекули води утворюють шестикутники — ось чому візерунок усіх сніжинок має шестикутний «каркас».
Тверде тіло — агрегатний стан речовини, що характеризується стабільністю форми на відміну від інших агрегатних станів рідини та газу.
Кристал — тверде тіло з упорядкованою внутрішньою будовою, що має вигляд багатогранника з природними плоскими гранями.
Кристалічна ґратка — геометрично правильне розміщення атомів (йонів, молекул), властиве речовині, що перебуває в кристалічному стані.
Аморфні речовини — твердотільні речовини, які не мають далекого порядку в розташуванні атомів.
АМОРФНІ ТІЛА
Аморфні тіла, хоч і розглядаються зазвичай як тверді, є переохолодженими рідинами. Якщо розглядати якийсь атом аморфного тіла як центральний, то найближчі до нього атоми будуть розташовуватися в певному порядку, але в міру віддалення від "центрального" атома цей порядок порушується, і розташування атомів стає випадковим. До аморфних тіл відносяться скло, пластмаси тощо.


Аморфними тілами є, наприклад, скляні предмети.
Аморфні тіла мають плинність, але значно меншу, ніж рідини. Плинність зростає з підвищенням температури.
Аморфні тіла посідають проміжне положення між рідинами та кристалами.
В аморфних тілах немає кристалічних ґраток.
Через відсутність кристалічної ґратки атоми або молекули в аморфних тілах час від часу «перескакують» з одного положення в інше у результаті чого форма тіла поступово змінюється.
Запис у зошит.
Властивості твердих тіл:
- Зберігають надану їм форму, об’єм.
- Характер молекулярного руху – коливання атомів та молекул відносно положення рівноваги.
- Частинки більшості твердих тіл, розміщені в певному порядку. Тверді тіла зберігають об’єм і форму. Кристалічна структура – характерна ознака твердого тіла.
Загалом зберігаючи форму, тверді тіла деформуються під впливом зовнішніх сил. В залежності від величини прикладеної сили деформація може бути пружною, пластичною або руйнівною.
Внаслідок нагрівання розширюються.
Дослід: візьмемо металеві кулю й кільце, розміри яких підігнані так, що за однакової температури куля проходить крізь кільце майже без зазору. Нагріємо кулю. Нагріта куля не проходить крізь кільце. Причиною цього є те, що тверді тіла внаслідок нагрівання розширюються.
Проте унаслідок нагрівання тверді тіла розширяються набагато менше, ніж рідини і гази.
Тверді тіла важкостисливі.
Тверді тіла значно різняться одне від одного. По-перше, вони відрізняються твердістю. По-друге, тверді тіла відрізняються одне від одного крихкістю. Так, склянка — крихке тіло: удар її руйнує. А свинцевий брусок — пластичне тіло: унаслідок удару він лише змінює форму.
Відмінною рисою твердого тіла в порівнянні з рідинами та газами є те, що воно чинить опір не тільки розтягу та стисканню, а також зсуву, згину й крученню.
Чи можливо на основі будови, руху та взаємодії частинок пояснити властивості тіл?
У чому особливість будови льоду? У твердих тілах молекули розташовуються у певному порядку.

Висновок. Властивості тіл залежать від особливостей їхньої молекулярної будови.

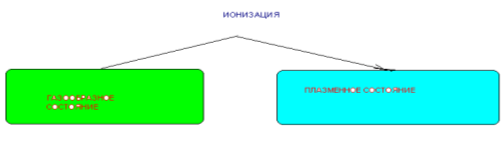
4. Плазма

Існує четвертий стан речовини – плазма. (частково або повністю іонізований газ, розігрітий до надвисокої температури). Детально вивчати плазмовий стан речовини ми будемо на другому курсі.
Плазма – електронейтральна сукупність нейтральних та заряджених частинок. Плазма, що складається з нейтральних атомів, електронів та іонів називається трикомпонентною. Реальна плазма – багатокомпонентна. Вона складається з атомів і молекул в основному та збудженому стані. Позитивних та негативних іонів, електронів та фотонів.
Численні приклади переходу речовини із одного агрегатного стану в інший, переконують нас у тому, що тверді тіла, рідини і гази – це не особливі речовини, яким властиві цілком певні ознаки, а стани, в яких може перебувати кожна речовина за певних фізичних умов.
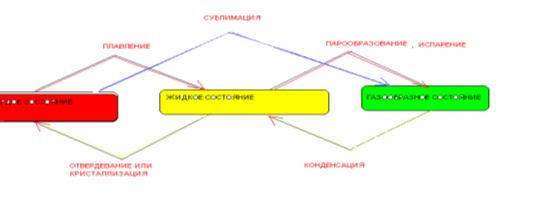
Розглянемо процеси, пов’язані із переходом речовини із одного агрегатного стану в інший:
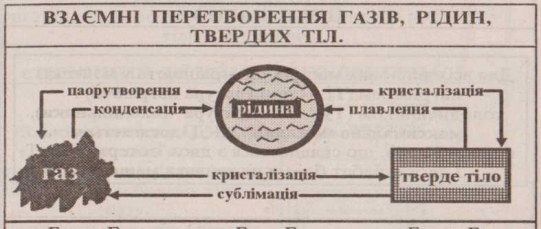
Фазові переходи
Фазовий перехід – перехід системи з одного агрегатного стану до іншого.


При фазовому переході стрибкоподібно змінюється яка - або фізична величина, наприклад, щільність, внутрішня енергія або змінюється симетрія системи.
РІДКІ КРИСТАЛИ
Рідкий кристал – це специфічний агрегатний стан речовини, у якому вона виявляє одночасно властивості кристала та рідини.

Деякі органічні речовини, що мають складні молекули, можуть утворювати рідкокристалічний стан. Цей стан здійснюється при плавленні кристалів деяких речовин. При їх плавленні утворюється рідкокристалічна фаза, що відрізняється від звичайних рідин.
Професії рідких кристалів
Багато сучасних приладів і пристроїв працюють на рідких кристалах. До таких відносяться годинник, термометри, дисплеї, монітори та інші пристрої.

Сонячний вітер
Сонячний вітер це потік плазми, що випускається сонцем. Він істотно впливає на магнітне поле Землі.

Полярне сяйво
Заряджені частинки сонячного вітру зупиняються магнітним полем Землі, починаючи циркулювати у радіаційних поясах атмосфери. Ця циркуляція викликає свічення атмосфери – полярне сяйво.

Хоча молекули рідин, газів і твердих тіл рухаються безладно, проте характер руху, розташування і взаємодія молекул різні, цим і пояснюється існування трьох агрегатних станів речовини.
Професійна спрямованість матеріалу. Залежно від агрегатного стану речовини змінюється рівень її пожежної небезпеки. Наприклад, деревина у твердому стані менш пожежонебезпечна ніж у пилоподібному, або моторна олива в рідинному стані менш пожежонебезпечна ніж у пароподібному та ін.
ІV. Розв'язування якісних задач (усно).
1. Чи можна заповнити газом посудину на половину його об'єму? Чому?
2. Чи можуть бути в рідкому стані при кімнатній температурі: кисень, азот?
3. Чи можуть бути в газоподібному стані при кімнатній температурі: ртуть, залізо?
4. В зимовий морозний день над ополонку в річці утворився туман. Яке це стан речовини?
5. У кімнаті, де знаходиться нафталін, завжди відчувається його запах. Поясніть, у якому стані перебуває нафталін?
V. Закріплення вивченого матеріалу.
1. Питання для контролю.
1. Чому газ легко стиснути?
2. Чому рідину практично неможливо стиснути?
3. Чому рідина, на відміну від твердих тіл, не мають своєї форми?
4. Чим відрізняється рух молекул льоду від руху молекул водяної пари?
5. Газ легко стиснути, а рідину практично стиснути неможливо. Чи пов’язана
ця відмінність із відмінністю у властивостях молекул газу та рідини?
6. Між молекулами існують сили притягання. Чому ж дві половинки зламаної
ручки не з’єднується, якщо їх щільно прикласти одна до одної?
7. Чому злипаються щільно притиснуті один до одного шматочки
пластиліну?
2. А тепер закріпимо наші знання
Робота з тренажером по диску Кирила та Мефодія.
3. Підсумкове тестування на інструктивних картах. Самоперевірка на слайді
Тести у двох варіантах.
Варіант I
1. Якими загальними властивостями володіють тверді тіла?
А. Власною формою та легко змінюваним об’ємом.
Б. Власною формою та об’ємом.
В. Власним обсягом та зміною форми.
2. Чим відрізняється, з молекулярної точки зору, цинк у твердому та рідкому станах?
А. Складом молекул.
Б. Нічим.
В. Розташуванням, взаємодією та рухом молекул.
3. Чому гази не мають власної форми?
А. Тому що молекули газу швидко рухаються.
Б. Тому, що молекули газу, практично не взаємодіючи, рухаючись вільно і хаотично, досягають всіх стінок судини, і газ набуває його форми.
В. Через дифузію.
Варіант IІ
1. Якими загальними властивостями володіють рідини?
А. Відсутність власних форм та об’єму.
Б. Володіння власною формою та об’ємом.
В. Наявність у них власного об’єму та плинності, отже, зміною форми.
2. У якому стані речовини його молекули зближені на відстані, менші за розміри самих молекул, сильно взаємодіють і залишаються на одних і тих же місцях, лише здійснюючи біля них коливання?
А. Рідкий.
Б.Газоподібний.
В. Твердий.
3. Чому гази займають весь наданий ним простір?
А. Тому що молекули газу швидко рухаються.
Б. Тому, що молекули газу, практично не взаємодіючи, рухаючись вільно і хаотично, досягають всіх стінок судини, і газ набуває його форми.
В. Внаслідок дифузії.
4. Вчитель пропонує учням скласти синквейн з одним із ключових слів (3-4 хвилини). Приклади ключових слів:
I синквейн – «пар»;
II синквейн – «вода»;
III синквейн – «лід».
VІ. Підсумок уроку
Про що ми дізнались на уроці
- Властивості газів: гази не зберігають ні об'єм, ні форму; газ заповнює всю ємність, у якій він знаходиться.
- Властивості рідин: рідини зберігають об'єм, але не зберігають форму; внаслідок здатності до переливання, рідина зазвичай приймає форму посудини.
- Властивості твердих тіл: тверді тіла зберігають об'єм і форму.
Підсумкова таблиця, заповнюємо наприкінці уроку у зошиті
|
|
Тверде тіло |
Рідина |
Газоподібна речовина |
|
Властивості а) форма б) об’єм |
Зберігає Зберігає |
Не зберігає Зберігає |
Не зберігає Займає весь об’єм |
|
Розташування |
Відстані між молекулами приблизно дорівнюють розміру молекул, порядок у розташуванні. Утворюють кристалічну решітку |
Відстані між молекулами приблизно дорівнюють розміру молекул, порядок відсутній |
Відстані між молекулами набагото більші від розміру молекул |
|
Стиснення |
Майже неможливе |
Майже неможливе |
Досить легко стиснути |
|
Рух |
Коливання |
Коливання, інколи “стрибки” |
Літають по всьому об’єму, інколи зазнають зіткнень |
|
Взаємодія |
Сильна |
Сильна Трохи слабша |
Під час зіткнень слабо притягаються і слабо відштовхуються |
VІ. Підсумок уроку. Рефлексія.
На сьогоднішньому уроці ви спробували себе у ролі маленьких дослідників. Я хочу побажати кожному з вас стати великим дослідником у своєму житті, чим би ви не займалися. Але нехай жодне погане слово, як тверда речовина, не зірветься із вашого язика. Всі добрі слова, як рідини, розтікаються до всіх людей, які вас оточують, і залишаються у їхніх серцях. А любов та вдячність, які ви промовляєте до своїх рідних та близьких, нехай підносяться до самої височини та досягають неба.
Домашнє завдання
§
Сторінка природодослідника
Виконай удома дослід. Для цього тобі знадобляться дві тарілки, вода.
Постав тарілки на освітлене сонцем підвіконня. Налий у кожну з них по дві столові ложки води. Для однієї тарілки зроби тінь. Спостерігай за змінами води в тарілках. Результати спостереження запиши в зошит. Зроби висновок про те, чому в одній з тарілок вода швидше перейшла з рідкого агрегатного стану.
Литература
- Фізика 10 клас. Барьяхтар В.Г, Довгий С.О, Кірюхіна О.О.
- О.М. Євлахов, М.В. Бондаренко. Физика, 10 класс. Поурочные планы.
“Жидкие кристаллы”
Всё чаще мы стали встречаться с термином “жидкие кристаллы”. Мы все часто с ними общаемся, и они играют немаловажную роль в нашей жизни. Многие современные приборы и устройства работают на них. К таким относятся часы, термометры, дисплеи, мониторы и прочие устройства. Что же это за вещества с таким парадоксальным названием “жидкие кристаллы” и почему к ним проявляется столь значительный интерес? В наше время наука стала производительной силой, и поэтому, как правило, повышенный научный интерес к тому или иному явлению или объекту означает, что это явление или объект представляет интерес для материального производства. В этом отношении не являются исключением и жидкие кристаллы. Интерес к ним, прежде всего, обусловлен возможностями их эффективного применения в ряде отраслей производственной деятельности. Внедрение жидких кристаллов означает экономическую эффективность, простоту, удобство.
Жидкий кристалл – это специфическое агрегатное состояние вещества, в котором оно проявляет одновременно свойства кристалла и жидкости. Сразу надо оговориться, что далеко не все вещества могут находиться в жидкокристаллическом состоянии. Большинство веществ может находиться только в трех, всем хорошо известных агрегатных состояниях: твердом или кристаллическом, жидком и газообразном. Оказывается, некоторые органические вещества, обладающие сложными молекулами, кроме трех названных состояний, могут образовывать особое агрегатное состояние — жидкокристаллическое. Это состояние осуществляется при плавлении кристаллов некоторых веществ. При их плавлении образуется жидкокристаллическая фаза, отличающаяся от обычных жидкостей. Эта фаза существует в интервале от температуры плавления кристалла до некоторой более высокой температуры, при нагреве до которой жидкий кристалл переходит в обычную жидкость. Чем же жидкий кристалл отличается от жидкости и обычного кристалла и чем похож на них? Подобно обычной жидкости, жидкий кристалл обладает текучестью и принимает форму сосуда, в который он помещен. Этим он отличается от известных всем кристаллов. Однако, несмотря на это свойство, объединяющее его с жидкостью, он обладает свойством, характерным для кристаллов. Это – упорядочение в пространстве молекул, образующих кристалл. Правда, это упорядочение не такое полное, как в обычных кристаллах, но, тем не менее, оно существенно влияет на свойства жидких кристаллов, чем и отличает их от обычных жидкостей. Обязательным свойством жидких кристаллов, сближающим их с обычными кристаллами, является наличие порядка” пространственной ориентации молекул.
“Полярное сияние”
Полярные сияния возникают, когда движущиеся с высокой скоростью заряженные частицы (электроны и протоны), излучаемые Солнцем, попадают в магнитное поле Земли и сталкиваются с молекулами газа в верхних слоях атмосферы. Столкновения заряженных частиц с молекулами азота и кислорода, приводят их в возбужденное состояние. Выделяя избыток энергии, молекулы кислорода дают яркое излучение в зелёной и красной областях спектра, а молекулы азота - в фиолетовой. В результате в небе над полюсами возникают разноцветные полосы протяженностью около 4000 километров. Такие процессы происходят только в верхних слоях атмосферы, т.к. во-первых, в низких плотных слоях столкновения молекул воздуха друг с другом сразу отнимает у них энергию, получаемую от солнечных частиц, а во-вторых, сами космические частицы не могут проникнуть глубоко в атмосферу Земли. Последние исследования показали, что молекулы воздуха возбуждаются в основном электронами. Как следует из названия, полярные сияния возникают в основном в районе полюсов Земли. Причина тому - отклонение заряженных частиц к полюсам магнитным полем Земли. Возникают полярные сияния, то есть свечение верхних разреженных слоев атмосферы, после взаимодействия атомов и молекул на высотах 90–1000 км. Полярные сияния симметричны, т.е. наблюдаются на обоих полушариях. Кроме того, это свечение наблюдается не только с земли, но и из космоса. Полярные сияния периодически наблюдаются у Венеры и Юпитера.


про публікацію авторської розробки
Додати розробку


