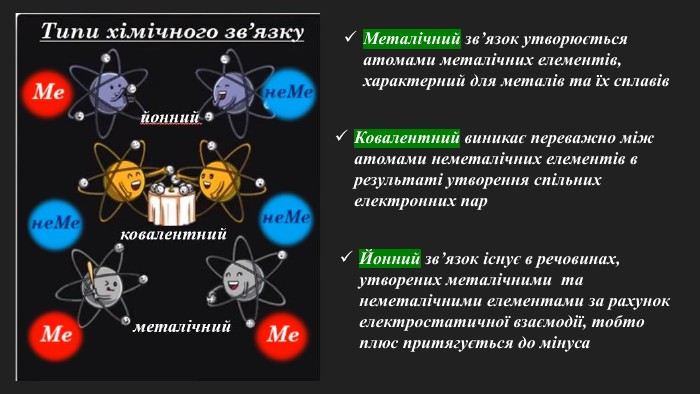
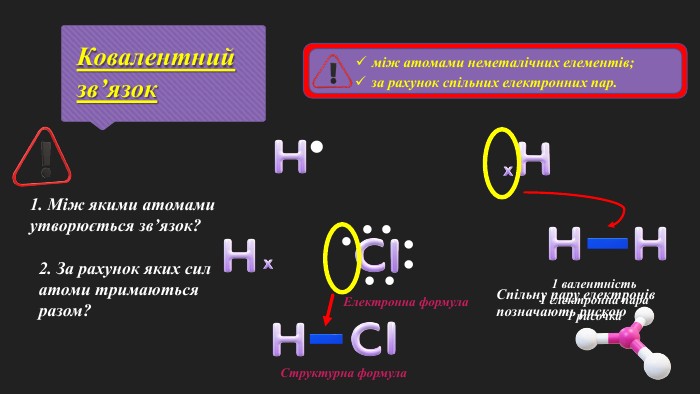
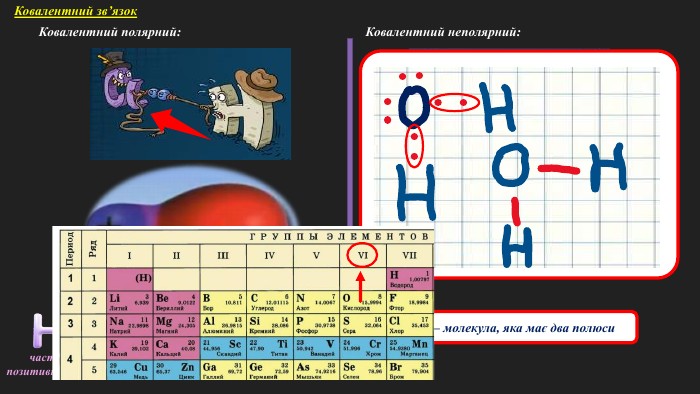
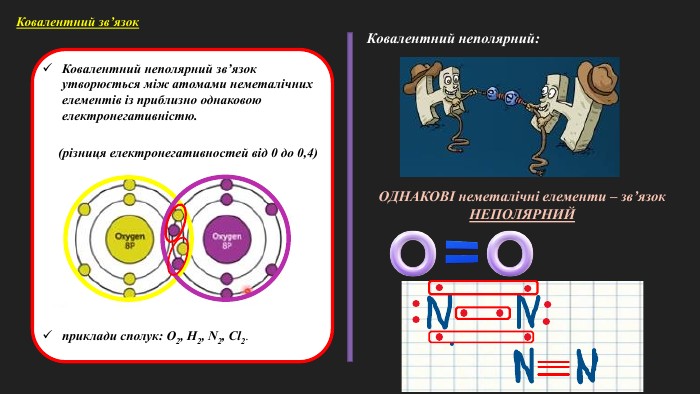
«Полярний і неполярний ковалентний зв’язок. Електронні формули молекул»
Про матеріал
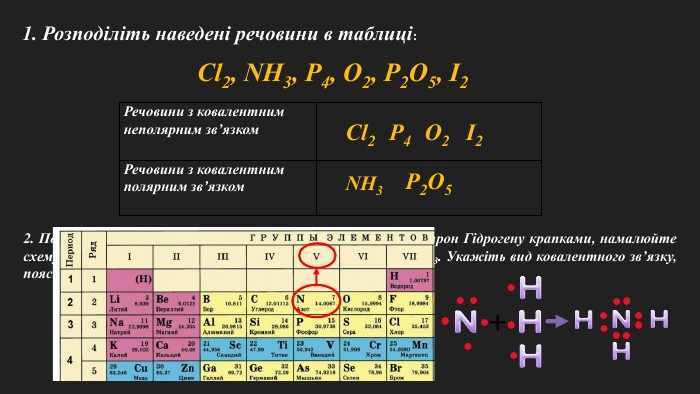
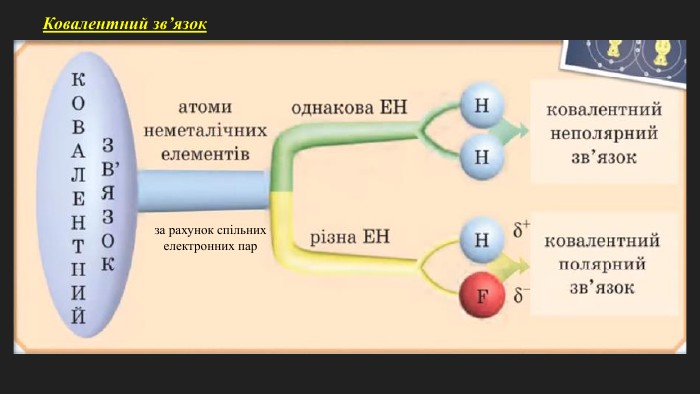
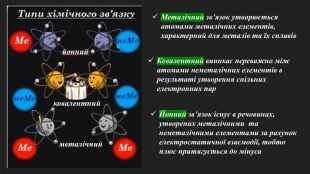
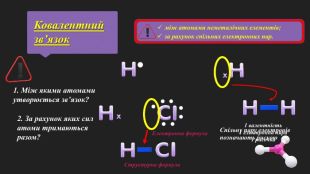
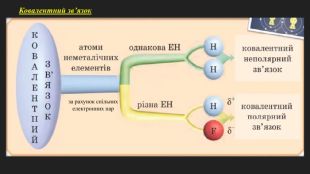
Мета: познайомити учнів з основними принципами утворення ковалентного хімічного зв’язку між елементами з різною електронегативністю; познайомити з електронними формулами молекул; сформувати вміння складати схеми утворення ковалентного зв’язку на прикладі хлороводню; пояснити відмінність ковалентного полярного від ковалентного неполярного зв’язку; розвивати логічне мислення; виховувати любов до предмету. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку