Поняття про будову атома та склад атомних ядер
В розробці йде мова про будову атома та склад атомних ядер. Під час уроку використано вірші, гру питання-відповідь, бліц-опитування, кросворд. Такі методи і прийоми допомагають краще розкрити тему уроку.
1
Тема. Поняття про будову атома та склад атомних ядер
Быть может, эти электроны –
Миры, где пять материков,
Искусства, знанье, войны, троны
И память сорока веков.
Ещё, быть может, каждый атом
Вселенная, где сто планет;
Там всё, что здесь в объёме сжатом,
Но также то, чего здесь нет.
В.Я.Брюсов
Мета: продовжувати формувати поняття про періодичну систему та періодичний закон на основі знань про будову атома та склад атомних ядер, про нуклони, про радіоактивність та радіоактивні елементи, про дослід Резерфорда продовжувати робити висновки; продовжувати формувати науковий світогляд на основі знань про будову та склад атома і атомного ядра; розвивати пізнавальну діяльність, хімічну мову, мислення, увагу, уміння аналізувати.
Методи: бесіда, гра, самостійна робота, кросворд.
Обладнання: комп’ютер, проектор.
Тип уроку: комбінований.
ХІД УРОКУ
І. Організаційний момент.
ІІ. Перевірка вивченого матеріалу.
1. * Бесіда за періодичною системою. Давайте детально поговоримо по періодичній системі.
2. * Самостійна робота. Як додатковий посібник можна використати диск, що зображений на малюнку:


І. 1. Яку характеристику можна дати натрію, виходячи з його положення в періодичній системі? (Натрій розташований у першій групі третього періоду періодичної системи хімічних елементів. На останній оболонці він має один електрон. Проявляє валентність один. Відноситься до лужних металів. Має три енергетичні оболонки. Заряд ядра +11, кількість протонів – 11, кількість електронів – 11, кількість нейтронів – 12. Відносна атомна маса – 23. Вищий оксид – Na2O. Агрегатний стан – твердий.).
2. Який з елементів алюміній чи сульфур проявлятиме більш виражені неметалічні властивості? Чому? (Сульфур, оскільки він знаходиться у VI групі, а отже на останній оболонці він матиме 6 електронів, на відміну від Алюмінію, у якого їх всього 3.)
3. Скільки нейтронів у силіцію? (28 – 14 = 14, 14 нейтронів).
ІІ. 1. Яку характеристику можна дати селену, виходячи з його положення в періодичній системі? (Селен розташований у VІ групі четвертого періоду періодичної системи хімічних елементів. На останній оболонці має 6 електронів. Проявляє валентність шість. Має чотири енергетичні оболонки. Заряд ядра + 34, кількість протонів – 34, кількість електронів – 34, кількість нейтронів – 45. Відносна атомна маса – 79. Вищий оксид – SeO3, воднева сполука – H2Se. Має 6 ізотопів. Агрегатний стан твердий).
2. Який з елементів фосфор чи стибій проявлятиме більш виражені металічні властивості? Чому? (Стибій, оскільки він знаходиться у 5 періоді, а отже матиме 5 енергетичних оболонок, на відміну від Фосфору, у якого таких оболонок всього 3).
3. Скільки нейтронів у алюмінію? (27 – 13 = 14, 14 нейтронів).
ІІІ. Мотивація навчальної діяльності.
Быть может, эти электроны –
Миры, где пять материков,
Искусства, знанье, войны, троны
И память сорока веков.
Ещё, быть может, каждый атом
Вселенная, где сто планет;
Там всё, что здесь в объёме сжатом,
Но также то, чего здесь нет. В.Я.Брюсов
Уважно прочитайте епіграф сьогоднішнього уроку. Як ви його розумієте?
Учні висувають припущення.
IV. Вивчення нового матеріалу.
1. * Гра “Питання – відповідь”.
Клас ділиться на три команди.
Завдання: учні уважно читають текст і готують питання для команд-суперниць, потім по черзі задають питання одна одній. Якщо команда, якій задано питання, не знає відповіді, то має змогу відповісти інша команда. Перемагає та команда, яка дасть більше правильних відповідей.
Приклади запитань:
1. Що таке радіоактивність? (Радіоактивністю називають самодовільний розпад нестійких атомних ядер, який супроводжується радіоактивним випромінюванням і утворенням частинок атома, а також інших елементів).
2. Як називають речовини, які мають здатність до радіоактивності? (Радіоактивними).
3. Хто досліджував радіоактивні елементи? (Подружжя Кюрі, Беккерель, Резерфорд).
4. Що вдалося встановити Резерфорду? (Що частина радіоактивного випромінювання у магнітному чи електричному колі розділяється на три пучки. Ці промені він назвав α-, β-, γ-промінням).
5. Що це відкриття дало змогу зробити Резерфорду? (Створити ядерну, або планетарну будову атома).
6. З чого складається атом згідно теорії Резерфорда? (З позитивно зарядженого ядра, а також електронів, що рухаються навколо ядра по електронним орбіталям і мають від’ємний заряд).
7. В якому році сталося це відкриття? (1909 – 1911).
8. У якому році і хто вів поняття “протон”? (1920 р. Резерфорд).
9. Хто, в якому році та де саме виявив нейтрон? (1932 р. Чедвік у ядрі атома).
10. До якого висновку прийшли Іваненко та Майоран? (Обґрунтували, що нейтрони і протони формують атомне ядро і визначають масу атома).
11. Що таке протонне число? (Число протонів у ядрі, яке збігається з порядковим номером елемента у періодичній системі).
12. Що таке нуклонне число? (Загальна кількість протонів і нейтронів у атомі).
V. Узагальнення і систематизація знань.
1. * Слово вчителя.
За допомогою слайдів показую дослід Резерфорда, який допоміг йому з'ясувати будову атома (див. слайд 1),
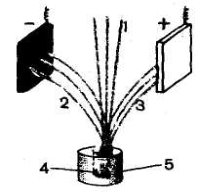 (слайд 1)
(слайд 1)
та які висновки допоміг зробити цей дослід Резерфорду (див. слайд 2).
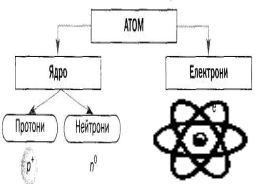 (слайд 2)
(слайд 2)
2. * Бліц-опитуваня.
1. Що таке радіоактивність? (Самодовільний розпад нестійких атомних ядер, який супроводжується радіоактивним випромінюванням і утворенням частинок атома, а також інших елементів).
2. Хто і в якому році відкрив будову атома? (Резерфорд у 1909 – 1911).
3. З чого складається атом? (З позитивно зарядженого ядра, а також електронів, що рухаються навколо ядра по електронним орбіталям і мають від’ємний заряд)
4. Що таке нуклонне число? (Загальна кількість протонів і нейтронів у атомі).
5. Що таке протонне число? (Число протонів у ядрі, яке збігається з порядковим номером елемента у періодичній системі).
6. Що таке хімічний елемент? (Сукупність атомів одного виду).
3. * Кросворд.
Давайте розгадаємо кросворд.
Знайдіть у періодичній системі елементи з вказаними протонними числами. Розмістіть їх назви так, щоб у вертикальному стовпці прочитати прізвище одного з творців атомно-молекулярного вчення.
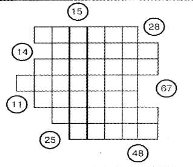
48 – Кадмій, 25 – Манган, 14 – Силіцій, 67 – Гольмій, 11 – Натрій, 15 – Фосфор, 41 – Ніобій (Дальтон).
VI. Домашнє завдання. § 31 вивчити, повторити типи хімічних реакцій, виконати вправи 4-6 ст. 146.


про публікацію авторської розробки
Додати розробку
