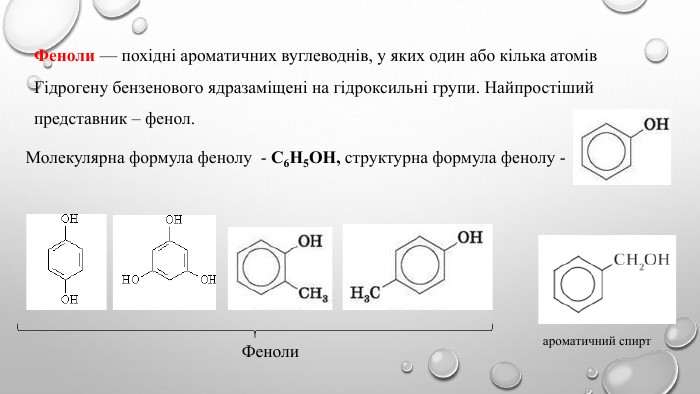
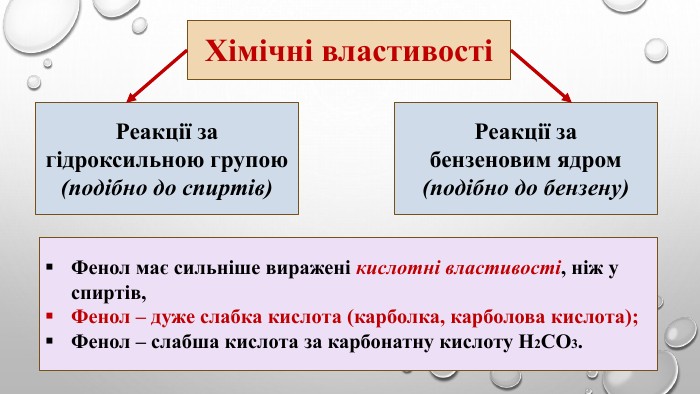
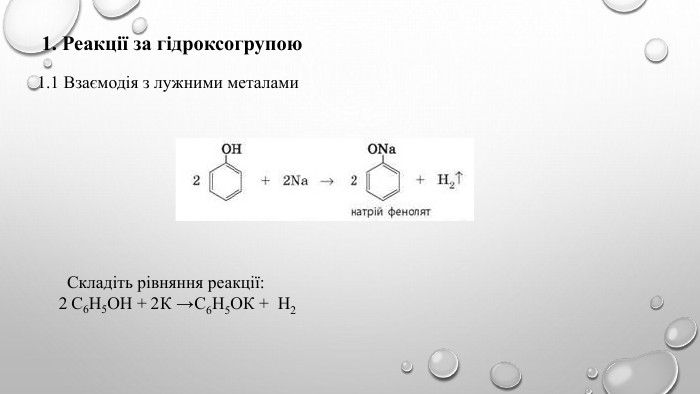
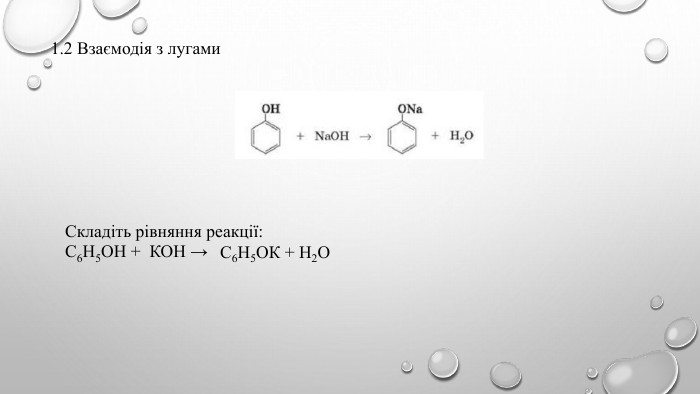
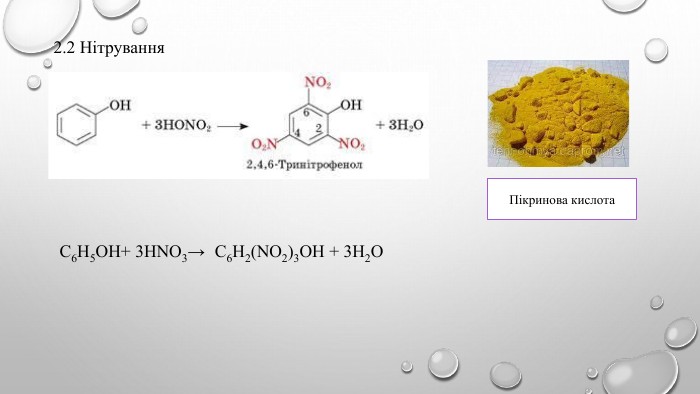
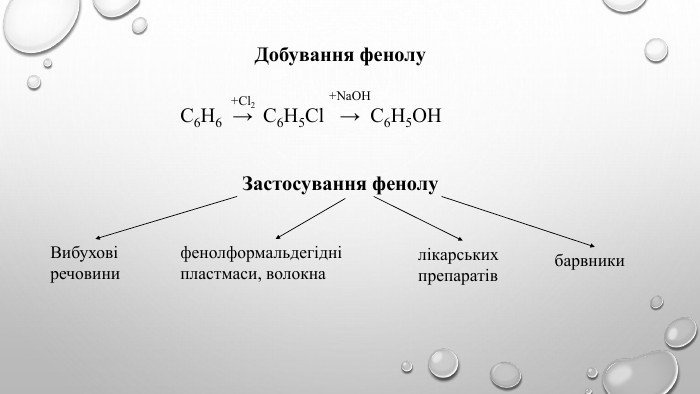
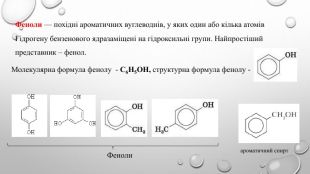
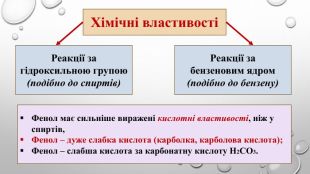
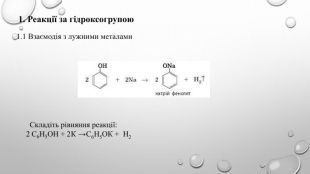
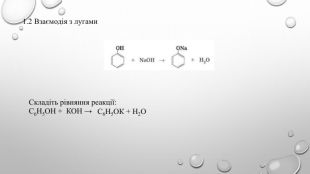
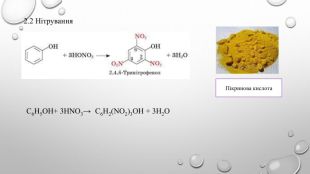
Поняття про фенол та його властивості
Про матеріал
Презентація до уроку хімії в 10 класі (рівень стандарт) за темою "Поняття про Фенол та його властивості". Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку